|
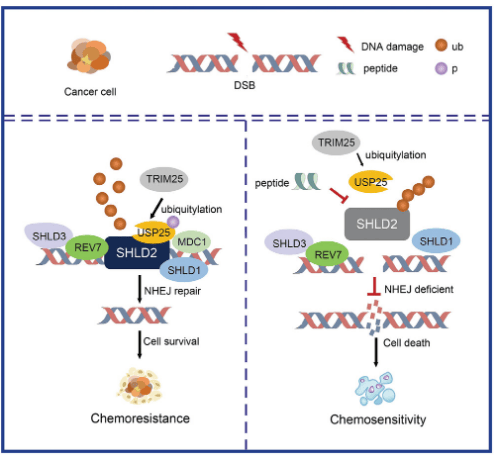
5月27日,同济大学医学院袁健、李昀辉一起通讯在期刊《ADVANCED SCIENCE》上在线发布题为“USP25 Elevates SHLD2-Mediated DNA Double-Strand Break Repair and Regulates Chemoresponse in Cancer”的科研论文,科研提出了一个机制模型,即USP25在K64位点用K63连接的多泛素链去泛素化和修饰SHLD2,从而促进NHEJ修复,从而降低癌细胞的化学敏锐性。而后,科研人员研发了基于破坏USP25-SHLD2结合的策略的肽,并证明肽与化疗药品的组合加强了结肠癌细胞和PDX模型的杀伤效率,这寓意着一种潜在的治疗策略,以加强化疗敏锐性并实现更好的结果。

科研背景
DNA损害反应(DDR)系统针对维持基因组完整性和防止DNA损害至关要紧。DDR通路功能阻碍引起基因组不稳定,这是肿瘤出现起始和发展的重要驱动力。DNA 双链断裂(DSB)是致命的病变,可诱发一系列细胞DNA损害反应。DSBs经过两种重点途径进行修复,即同源重组(HR)和非同源末端连接(NHEJ)。NHEJ通路修复增殖细胞中75%的DSB,并在全部细胞周期中出现。屏蔽DNA末端是起步DSB NHEJ修复的核心过程。近期的报告已将shieldin复合物确定为53BP1关联活性的新效应子,可促进NHEJ修复并限制DNA末端切除。shieldin复合物由C20orf196(SHLD1)、FAM35A(SHLD2)、CTC-534A2.2(SHLD3)和REV7构成,SHLD2是该复合体中的重要调节因子。SHLD2的N端与REV7结合,促进SHLD2募集到DSB。SHLD2的C末端与ssDNA末端结合,经过与EXO1和DNA2竞争来防止DNA末端的切除。SHLD2针对促进NHEJ和抗体类别开关重组(CSR)至关要紧。SHLD2的高表达与乳腺癌病人的不良预后关联。然而,对掌控SHLD2活性的调控机制知之甚少。
翻译后修饰(PTM)在调节蛋白质功能中起着至关要紧的功效。NHEJ通路中重要调节因子的许多PTM已被证明与肿瘤出现和癌症治疗有关。详细来讲,ATM对53BP1 N末端的S/T-Q位点进行磷酸化是DNA末端守护和免疫球蛋白类转换重组(CSR)所必需的,促进其与RIF1的相互功效,激活NHEJ修复和癌细胞存活。另外,RNF168对K1268的53BP1泛素化对NHEJ修复、维持基因组稳定性和放射敏锐性至关要紧。然而,调节SHLD2的PTM尚未得到广泛的表征。
科研发掘
在这项科研中,证明去泛素化酶USP25促进非同源末端连接(NHEJ),从而促进癌症的化疗耐药性。结果显示,USP25在K64位点使SHLD2去泛素化,从而加强其与REV7的结合并促进NHEJ。另外,USP25缺陷会损害NHEJ介导的DNA修复并降低 USP25 缺陷小鼠的类别转换重组(CSR)。USP25在结肠癌的一个亚群中过表达。USP25的耗竭使结肠癌细胞对IR、5-Fu和顺铂敏锐。TRIM25亦被鉴定为一种E3连接酶,负责降解USP25 。TRIM25的下调引起USP25水平上升,从而诱导结肠癌细胞的化疗耐药性。在PDX模型中,成功鉴定了一种破坏USP25-SHLD2相互功效的肽,损害了NHEJ并增多了对化疗的敏锐性。总体而言,这些发掘揭示了USP25是SHLD2调节NHEJ修复途径的重要效应因子,并显示其做为癌症治疗靶点的潜能。
科研结论
综上所述,科研提出了一个机制模型,即USP25在K64位点用K63连接的多泛素链去泛素化和修饰SHLD2,从而促进NHEJ修复,从而降低癌细胞的化学敏锐性。而后,科研人员研发了基于破坏USP25-SHLD2结合的策略的肽,并证明肽与化疗药品的组合加强了结肠癌细胞和PDX模型的杀伤效率,这寓意着一种潜在的治疗策略,以加强化疗敏锐性并实现更好的结果。
本文链接:https://www.360worldcare.com/medical.article-4996-11.html返回外链论坛:http://www.fok120.com/,查看更加多
责任编辑:网友投稿
|