|

科研介绍
科研背景
Bac公斤round
癌症是世界范围内人类死亡的重点原由之一。放射药品治疗(RPT)做为一种新的癌症治疗方式,导致了高度的认可和商场兴趣。RPT将放射性核素传递到肿瘤关联靶点,控制或破坏肿瘤组织,达到治疗目的。然而,很少有放射性核素本身能够选取性靶向肿瘤部位,放射性药品的有效应用取决于选取合适的载体。
科研目的
Objectives
本文旨在概述不同类型的放射性药品载体及其特点,以及相应放射性药品在癌症治疗中的最新发展和应用。
重点概括
1、放射性标记抗体:基于抗体的放射性药品已广泛应用于癌症治疗,然则日前仅有两种药品得到了FDA的准许。放射性标记抗体在实体癌中的应用仍然是一个挑战,然而抗体工程或放射性核素的新发掘以及预靶向策略的运用正在试图克服这些问题。
2、放射性标记肽:一种相对较新、特异性强的放射性药品。人们对研发稳定且定义知道的新型肽载体系统越来越感兴趣,如异源二聚体和环肽,它们为新的放射性标记肽在癌症治疗中带来了期盼。
3、放射性标记肽核酸:尽管基于寡核苷酸的放射性药品在生物医学行业取得了一系列成功,但临床转化仍然缓慢,仍有许多挑战有待处理。
4、放射性标记小分子:放射性标记的小分子在mCRPC方面取得了重大发展。177 Lu-PSMA-617已得到FDA准许,运用不同放射性核素和缀合物的其他多项临床实验正在进行中。
抗体、多肽、核酸和小分子修饰的NPs正在积极科研中,同化疗、外束放疗、分子靶向治疗等疗法联合,RPT在肿瘤治疗中有潜能达到其所有疗效。
科研发掘
1
放射性标记抗体
放射性标记抗体的特点
抗体是最早用于放射性药品的生物载体。对肿瘤上的靶抗原拥有高亲和力和特异性,尤其是单克隆抗体(mAbs)及其衍生物。然则因为其相对较高的分子量,完整单克隆抗体存在固有的缺点,包含实体肿瘤内的药代动力学缓慢和低扩散性。虽然抗体片段能够改善实体瘤治疗的药代动力学,但稳定性降低,在健康组织中表现出明显程度的非特异性累积。
经准许的放射性标记单克隆抗体及衍生物:放射性标记抗CD20小鼠单克隆抗体90Y-ibritumomab tiuxetan (Zevalin)、131I - tositumumab (Bexxar)、利妥昔单抗、131I-Metuximab、 131I-chT。
在治疗非霍奇金淋巴瘤(NHL)的应用
放射标记抗CD20嵌合单抗利妥昔单抗有很大的潜能用于非霍奇金淋巴瘤。利妥昔单抗能够经过内源性和外源性凋亡途径诱导抗体依赖性细胞毒性和细胞凋亡。一项II期科研显示,99%的NHL病人对131 i标记的利妥昔单抗有完全或部分反应,且该治疗毒性低且比化疗更便宜。
预靶向RPT是一种特别有前景的新办法,旨在加强清除率和减少脱靶毒性,从而最小化毒性和最大化治疗反,包含链霉亲和素-生物素和双特异性抗体(bsAbs)预靶向办法。在链霉亲和素-生物素法中,单克隆抗体和放射性药品分别运用。生物素对链霉亲和素的亲和力高于抗原-抗体的平均亲和力,一个链霉亲和素分子能够结合多种放射性生物素。这里基本上,能够向目的组织传送更高剂量的辐射。临床前科研显示,链霉亲和素生物素RPT治疗淋巴瘤的疗效比直接放射标记的单克隆抗体更好,毒性更低异种移植。然而,链亲和素-生物素RPT受其免疫原性和对内源性生物素的干扰的限制,这可能使该办法的临床转化繁杂化。双特异性抗体(bsAb)预靶向办法包含运用对放射性标记半抗原和肿瘤关联抗原都有亲和力的未标记bsAb。按照bsAb预靶向办法,bsAb的一只手臂靶向肿瘤抗原,另一只手臂识别用于RPT的放射性标记半抗原。与直接放射性标记单克隆抗体相比,这种预靶向办法加强了靶向放射性核素治疗NHL的疗效。例如,Sharkey等人报告了运用抗CD20 bsAb TF4和90 Y-DOTA肽的预靶向办法,即使在相对较低的剂量下,亦能明显加强存活率,治愈33%至90%的淋巴瘤裸鼠。
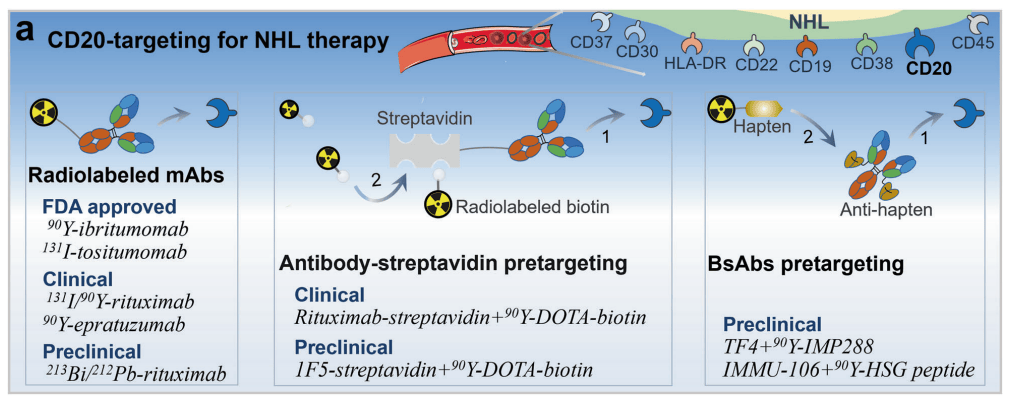
在治疗结直肠癌(CRC)的应用
最平常的靶向抗原包含癌胚抗原(CEA)、上皮细胞粘附分子、结肠特异性抗原p等。CEA在约95%的结直肠癌中表达,是最常用的靶向抗原。迄今为止,许多临床实验已然评定了抗CEA RPT的疗效。bsAb预靶向办法已被研发用于CRC中的CEA靶向。例如,临床前和临床科研显示,bsAb (TF2)和放射性标记半抗原肽(IMP288)的预靶向能够特异性和快速靶向肿瘤,并控制肿瘤生长。放射性标记的抗CEA抗体片段,如minibody、F(ab )和diabod亦被用于CRC的治疗科研。

2
放射标记肽
放射标记肽的特点
多肽易于合成和放射性标记,拥有良好的药代动力学,低放射性毒性和免疫原性等,使其作为有吸引力的放射性药品载体,尤其是异二聚肽和双环肽的发展供给了强大的载体体系。
放射性标记生长抑素(SST)类似物177 Lu-DOTA-TATE于2018年被FDA准许用于治疗成人SST阳性胃肠胰神经内分泌肿瘤(GEP-NETs)病人。SST是一种含环二硫键的肽激素,可与全身表达的5种生长抑素受体亚型(SSTR1-5)结合。SST类似物是用于NENs的最先进的放射性药品,它重点有两大类:激动剂和拮抗剂。激动剂奥曲肽是第1个合成的SST类似物,两种平常的放射性标记结构DOTATOC和DOTATATE亦是激动剂,评定177 Lu-DOTA-TOC在GEP-NETs病人中的有效性和安全性的III期实验正在进行中(NCT03049189),预计将于2029年6月完成。SSTRs拮抗剂如LM3和JR11的引入是SSTRs靶向行业的要紧发展。临床前和临床科研显示,与激动剂相比,SSTR拮抗剂与SSTR的结合能力更好,肿瘤摄取率更高,并且能够供给更高的辐射剂。运用放射性标记的SSTR拮抗剂可能为NETs供给更成功的治疗策略。

放射标记肽在治疗前列腺癌(mCRPC)的应用
前列腺癌过表达特异性受体,包含胃泌素释放肽受体(GRPR)、前列腺特异性膜抗原(PSMA)、整合素等。放射性标记蛙皮素(Radiolabeled bombesin, BBN)类似物对GRPR拥有高亲和力和特异性,在GRPR阳性癌症治疗行业的科研始终蓬勃发展。首个用于治疗的放射性标记蛙皮素类似物是强效GRPR激动剂177 Lu-AMBA,它以高亲和力与GRPR结合,表示出很高的治疗潜能。然而,一项针对转移性去势抵抗病人的I期升级科研中发掘,注射177 Lu-AMBA治疗剂量后显现严重不良反应,前列腺癌(mCRPC)病人被停止治疗。近年来,科研人员始终在研发放射性标记的异源二聚体。例如,异二聚肽(RGD-Glu-[90Y-DO3A]-6- Ahx - RM2)和小分子连接肽125I-BO530。与相应的单价肽配体相比,异源二聚体能够同期或独立结合不同的靶受体,从而与靶细胞的结合更强。
放射标记肽在治疗神经胶质瘤的应用
胶质瘤细胞表达特异性受体和糖蛋白,如神经激肽1型受体(NK1R)、整合素、MMP-14等。P物质是NK1R的天然配体,因此呢放射性标记的P物质类似物可用于靶向NK1R治疗胶质瘤。放射标记的异二聚体肽在胶质瘤的临床前科研中表示出非常有利的结果。如2022年Liu等人利用放射性标记的异二聚肽iRGDC6-lys(211At-ATE)-C6-DA7R靶向整合素和VEGF受体治疗胶质瘤,可显著控制肿瘤生长,延长载瘤小鼠的存活期。放射性标记双环肽在癌症治疗中拥有巨大的前景。双环肽能够人工合成,拥有高亲和力和选取性,拥有高肿瘤穿透性和快速从正常组织排出的特点。基于纳米医学的办法正被用于研发胶质母细胞瘤的创新治疗策略。2022年,Silva等人设计了177个携带P物质衍生物的lu标记AuNPs,在胶质母细胞瘤细胞中表示出明显的放射生物学效应,细胞摄取和内化程度高,细胞活力和存活率降低,值得进一步的临床前评定。
3
放射标记核酸
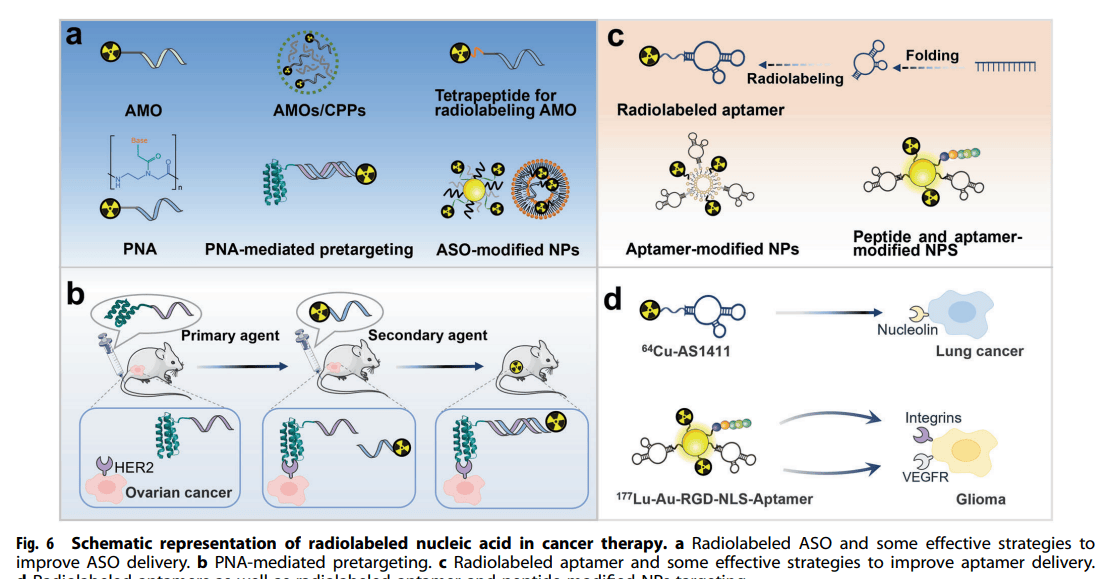
放射标记核酸的特点与应用
核酸载体由多种结构变体构成。反义寡核苷酸(ASO)和核酸适体做为放射性药品载体非常有前景。日前,放射性标签ASO已然取得了一系列成功。许多更有效的策略改善ASO的传递。例如,采用细胞穿透肽基纳米探针,优化标注办法,应用核酸类似物反义肽核酸(PNA),运用RNA介导的预靶向,利用寡核苷酸功能化的NP等。
4
放射性标记小分子
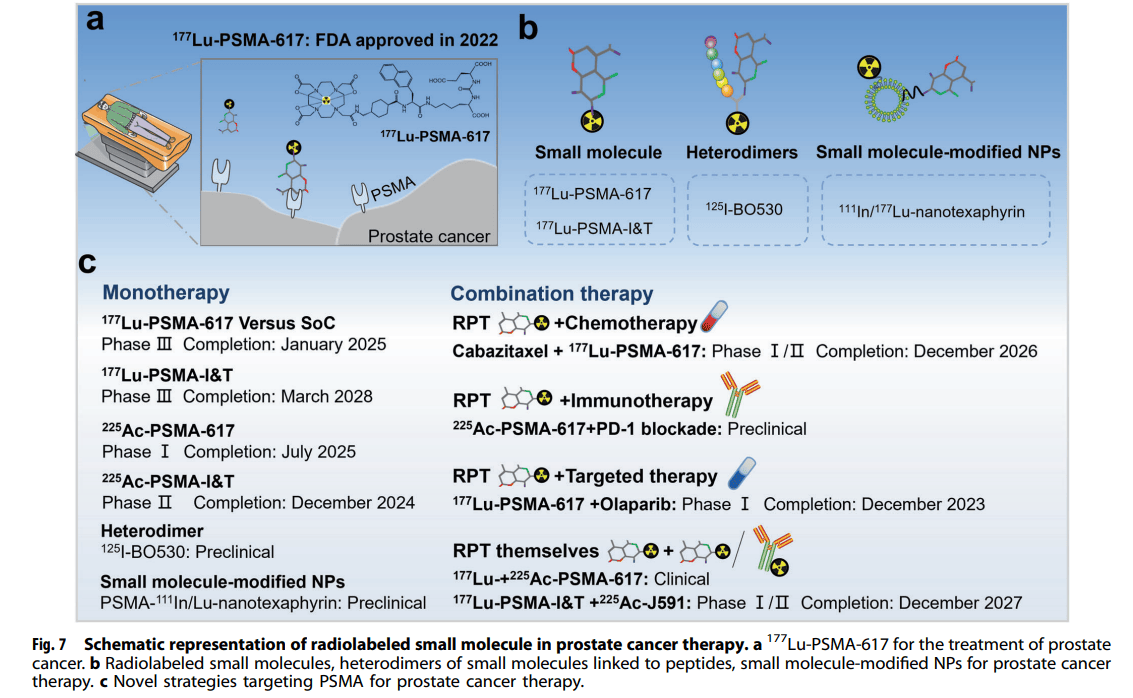
放射性标记小分子的特点与应用
小分子放射性药品能够快速穿透肿瘤,从非靶组织中快速清除等,从而降低毒性,与大分子相比。这种治疗办法正受到越来越多的关注。
2022年,放射性标记小分子177 Lu-PSMA-617被FDA准许用于雄激素受体途径控制和紫杉醇化疗后PSMS阳性mCRPC的治疗。有报告叫作放射标记的异源二聚体加强了前列腺癌治疗的特异性和准确性。例如,Abouzayed等人合成为了PSMA/ GRPR靶向的异二聚体125 I-BO530,该异二聚体由PSMA-617与肽连接形成,在体外和身体均表现出靶向特异性和长期的活性保持。小分子修饰的NPs亦加强了NPs靶向癌细胞的特异性。2022年,Cheng等人报告了高特异性PSMA靶向配体的包括使111 In/177 Lu-nanotexaphyrin在PSMA阳性前列腺肿瘤中优先累积,并在异种移植模型中成功控制肿瘤生长。多项其他临床前和临床科研亦在评定针对PSMA的前列腺癌治疗新策略,包含单药治疗和联合治疗。日前正在进行一项评定225 Ac-PSMA-617在前列腺癌病人中的安全性的I期科研,预计将于2025年7月完成(NCT04597411)。同期,225 Ac-PSMA-I&T用于mCRPC的II期实验正在进行中,预计将于2024年12月完成(NCT05219500)。有些实验正在科研PSMA-RPT联合其他治疗方式来改善癌症治疗,包含化疗(NCT05340374)、免疫治疗和靶向治疗(NCT03874884)。例如,Czernin等人发掘PSMA RPT和PD-1阻断拥有协同抗肿瘤功效。与单药治疗相比,225 Ac-PSMA-617和抗pd -1联合治疗明显改善了前列腺癌小鼠模型的疾患掌控。有一项I/II期临床实验联合177 Lu-PSMA-I&T和mAb 225 Ac-J591治疗进行性mCRPC,预计科研完成日期为2027年12月(NCT04886986)。基于小分子的RPT在过去几年中取得了重大发展,这种治疗办法可能在将来几年发挥越来越要紧的功效。
5
放射性标记纳米粒子
放射性标记纳米粒子的特点
NPs做为放射性药品载体的应用发展快速,进一步加强了放射性药品的治疗效果。NPs大致能够分为有机NPs和没机NPs。有机NPs包含脂质体、树状大分子和聚合NPs。没机纳米粒子包含金纳米粒子、二氧化硅纳米粒子和碳基纳米粒子。它们做为放射性核素载体在癌症治疗中被广泛讨论。
放射性标记纳米粒子在癌症中的应用
2022年,Huang等人证明静脉注射AuNPs 211 At-AuNPs@mPEG可明显控制胰腺癌模型中的肿瘤生长,为静脉注射适合RPT的NPs设计供给了新的框架。NP已被多肽、抗体和适体等有效功能化,以特异性结合肿瘤受体,并且这些靶向配体与NP结合的数量可能远不止一个。例如González-Ruíz等人对负载177 Lu的适体和肽标记的AuNPs的治疗效果进行了评估,发掘其在体外和身体均明显降低肿瘤细胞活力,控制肿瘤发展。近年来,人们对放射性标记的NPs进行了许多临床前科研,它们有望在癌症治疗中发挥重要功效。
参考文献
[1] Zhang T, Lei H, Chen X, Dou Z, Yu B, Su W, Wang W, Jin X, Katsube T, Wang B, Zhang H, Li Q, Di C. Carrier systems of radiopharmaceuticals and the application in cancer therapy. Cell Death Discov. 2024 Jan 9;10(1):16. https://doi.org/10.1038/s41420-023-01778-3.
END
文案 | 石利欣
排版 | 石利欣
审核 | 夏小倩
颁布|姜笑南
世界生命科学大会
RECRUIT
关注咱们,获取生命科学
学界前沿|促进更加多的学术交流与合作
业界前沿|促进更快的制品创新与应用
政策前沿|促进更好的治理实践与发展返回外链论坛:http://www.fok120.com/,查看更加多
责任编辑:网友投稿
|