|
2024年5月14日
医麦客资讯 eMedClub News
自从首款嵌合抗原受体(CAR)-T细胞疗法在2017年得到FDA准许败兴,已有多款CAR-T疗法得到全世界监管单位的准许,展现其治愈癌症的潜能。然而,这些获准CAR-T疗法的适应症多集中于B细胞类血液癌症,重点原由之一是因为靶向T细胞抗原可能会诱发CAR-T细胞自相残杀(fratricide),从而影响整体治疗效果。然而经过单碱基编辑(base editing)技术,专家已然研发出靶向T细胞的CAR-T细胞疗法,并在临床上得到验证。除另外,潜在靶向所有血液肿瘤类型的CAR-T疗法亦已在临床前实验中展现积极抗癌效力。CAR-T疗法正在逐步且深入地扩展其在癌症治疗的应用。
多重碱基编辑CAR-T细胞治疗T细胞癌症获临床验证
eMedClub
为了研发出用以治疗T细胞血液癌症且不会相互残杀的CAR-T细胞,来自大奥蒙德街医院(Great Ormond Street Hospital)的专家团队运用胞嘧啶碱基编辑器(coBE)对T细胞进行多重编辑。这种胞嘧啶碱基编辑器将一种改变碱基的脱氨酶(deaminase)与没酶切活性的Cas9变体融合在一块,可在细胞内不产生DNA双链断裂的情形下制造C-G至T-A点突变,以产生过早终止暗码子或破坏剪接位点来达到沉默特定基因表达的效果。
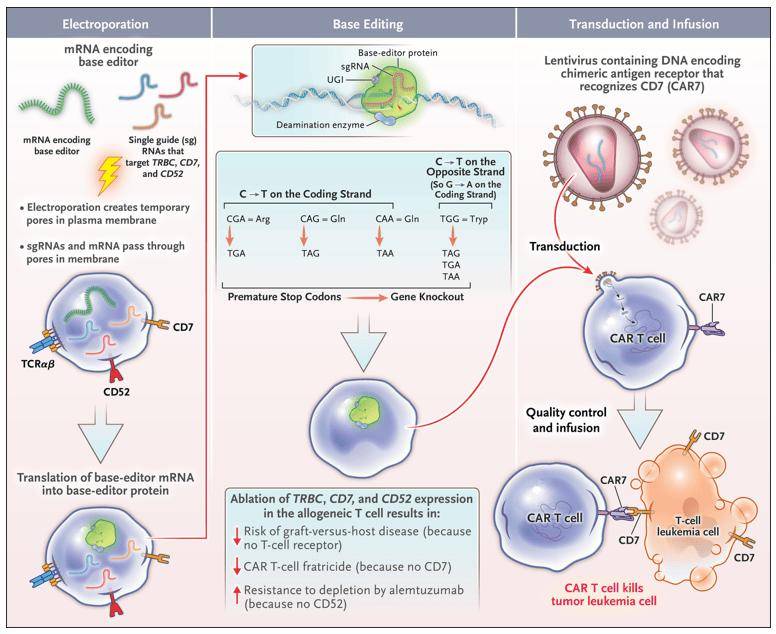
▲经过碱基编辑制造靶向T细胞的CAR-T疗法(照片源自:参考资料[2])
该科研团队将靶向TRBC1和TRBC2(编码T细胞受体β链)、CD7和CD52 mRNA的3个单向导RNA(sgRNA)与编码coBE的mRNA,经过电穿孔的方式送入健康捐赠者的T细胞中,并接着运用编码CAR的慢病毒载体转染这些细胞,从而生成碱基编辑的靶向CD7的CAR(BE-CAR7)-T细胞库,用以治疗复发性或难治性T细胞急性淋巴细胞白血病(T-ALL)儿童病人。经过单碱基编辑破坏T细胞受体可防止CAR-T细胞攻击病人的常驻T细胞,从而避免移植物抗宿主病(GvHD)的出现。而经过敲除CD7的表达则可避免CAR-T细胞自相残杀。另外,CD52的失活则可保证病人在接受预处理方法中像是Campath(alemtuzumab)这类CD52靶向疗法治疗时,所接受的同种异体CAR-T细胞能够存活。
这项1期实验中接受该疗法的前三位T-ALL儿童病人的治疗结果颁布于去年的《新英格兰医学杂志》其中,其中两位病人在接受BE-CAR7治疗后一月内达成完全缓解!首例病人是一名13岁女子,她在接受同种异体干细胞移植后T-ALL产生复发,在输注单剂量BE-CAR7细胞后28天内实现了分子缓解。她后来接受来自原始捐赠者的低强度同种异体干细胞移植后,成功实现免疫重建和持久的白血病缓解。来自同一细胞库的BE-CAR7在另一两例病人中也表示出有效活性,其中一例病人出现致命的真菌并发症,另一例病人则在缓解时期接受了同种异体干细胞移植。
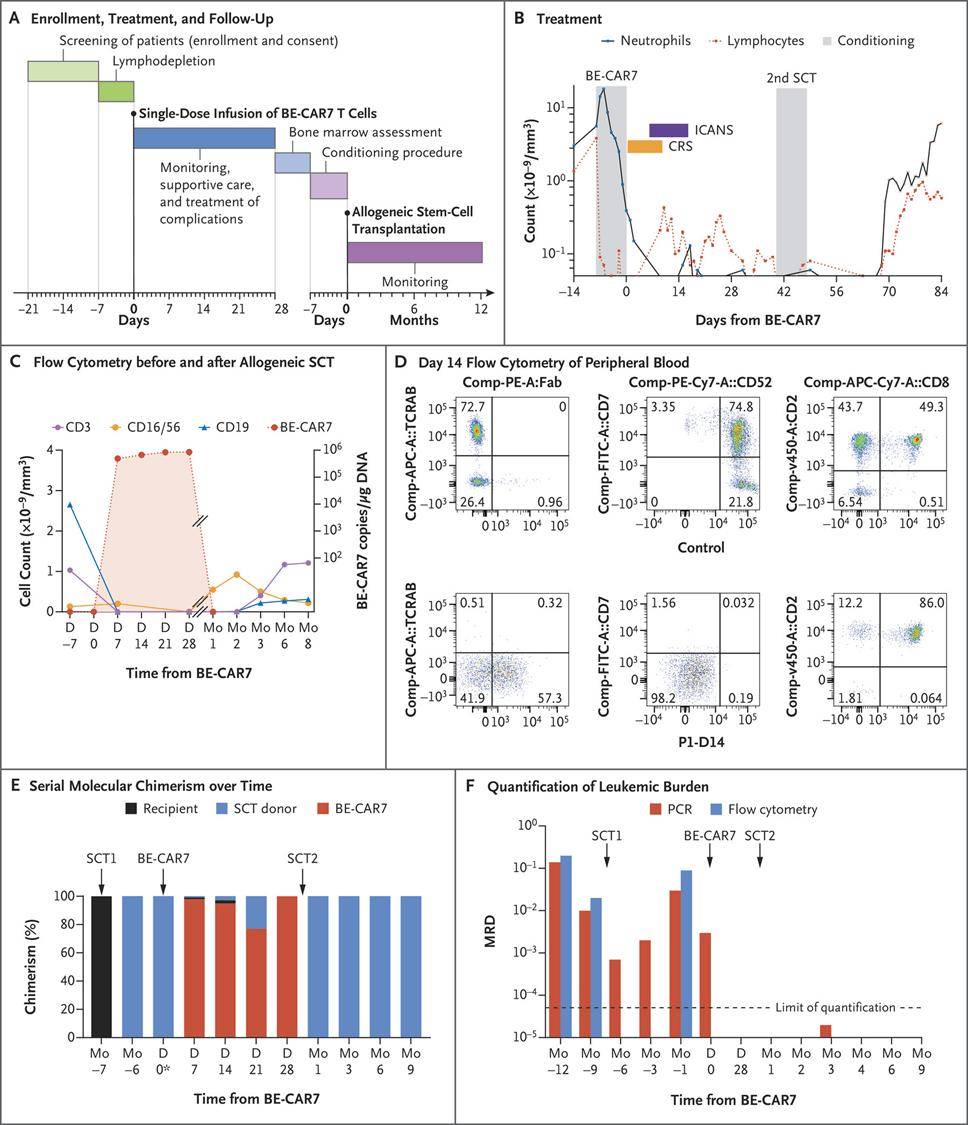
▲接受BE-CAR7治疗首位病人的疗效结果(照片源自:参考资料[2])
虽然在实验其中病人出现包含细胞因子释放综合症和机会性感染等严重不良事件,这项实验没疑证实多重单碱基编辑在临床应用上的可行性,并进一步扩展CAR-T疗法的应用范围。研发中的类似疗法还有Beam Therapeutics的BEAM-201。与BE-CAR7不同的是,除了对以上所提基因进行编辑外,BEAM-201还对T细胞的PD-L1进行编辑,目的是潜在避免T细胞耗竭与延长细胞存活时间,该疗法已在去年完成首次病人给药。另外,Wugen机构亦在去年美国血液学会(ASH)年会上颁布其经双重编辑的同种异体CD7靶向CAR-T疗法WU-CART-007用于治疗T-ALL或淋巴细胞淋巴瘤(LBL)的全世界1/2期临床实验数据。分析表示,WU-CART-007表现出可控的安全性,未观察到GvHD。在剂量水平≥2的18例疗效可评定病人中,复合完全缓解(CRc)率为67%,接受举荐的2期剂量(RP2D)治疗病人的CRc为73%。

▲WU-CART-007实验疗效结果(照片源自:参考资料[3])
6月·IBI EXPO
主题论坛举荐
(上下滑动查看更加多)
潜在治疗所有类型血液肿瘤的CAR-T疗法
eMedClub
研发出能够潜在治疗T细胞癌症的CAR-T疗法是一项令人鼓舞的医学发展,然而单碱基编辑在创新CAR-T疗法研发上的应用不仅限于此。碱基编辑使得专家能够在维持基因功能的同期引入单核苷酸改变,从而创造出新型的治疗靶标。这种办法被叫作为表位编辑(epitope editing),可进一步扩大CAR-T细胞疗法的范围,涵盖所有血液癌症,包含哪些缺乏可靶向癌症特异性抗原的癌症。
表位编辑的应用在去年8月两篇临床前科研其中得到初步证实。由宾夕法尼亚大学Saar Gill博士所带领的科研团队利用腺嘌呤碱基编辑器,将CD45蛋白转化为所有血液系统恶性肿瘤的可行CAR靶标。CD45是一种表达于几乎所有血液细胞表面的蛋白。科研人员将一种功能保存、可逃避CAR攻击的CD45安装到造血干细胞和CD45靶向的CAR-T细胞中。而后,她们将这两种经修饰的细胞输注入身患急性髓系白血病的小鼠身体。实验结果表示,CAR-T细胞可发动针对癌细胞专一性的攻击,且本身并不相互残杀,而经表位编辑的干细胞则在小鼠身体成功重建了一个健康的免疫系统。这项技术有潜能治疗任何血液或骨髓癌。Gill博士打算授权该技术或创建一家机构以将之进一步应用于临床。
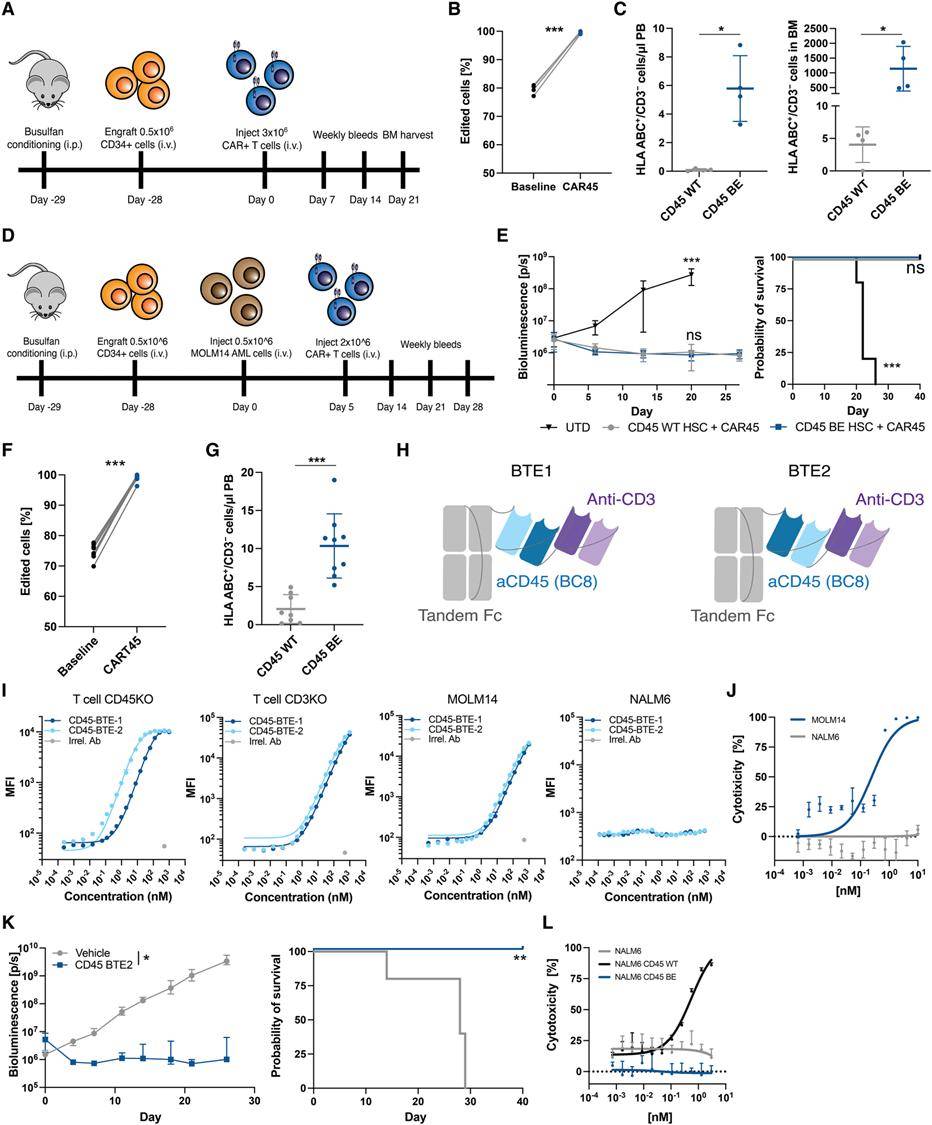
▲经表位编辑的造血系统不受CD45靶向CAR-T细胞攻击(照片源自:参考资料[4])
另一项科研则是由于来自丹娜-法伯癌症科研所(Dana-Farber Cancer Institute)的Pietro Genovese博士所领导。他的团队一样采用了腺嘌呤碱基编辑器来创建造血干细胞,使得经编辑后的造血干细胞表面蛋白与白血病细胞所表达的蛋白仅存在一个氨基酸的差异。这一微小的变化使得小鼠身体的癌症得以根除,同期不影响正常的造血系统。Genovese博士打算起步一项临床实验,让急性髓系白血病病人接受经表位编辑的同种异体干细胞的移植。若日后病人的癌症复发,大夫将能够在避免靶向与非靶向毒性的同期,用CAR-T细胞或其他疗法有效对抗癌细胞。
以上这些科研表示,若能有效、策略性地将新兴技术相结合,则有望扩大治疗范畴,造福更加多病人。随着学术界与产业界连续持续在单碱基编辑技术与CAR-T疗法上的改进,相信在将来会有更加多癌症病人受惠,让咱们一起期待。
参考资料:
[1] Dolgin, Elie. “Super-resistant CAR Ts take on cancers.” Nature biotechnology vol. 42,1 (2024): 5-7. doi:10.1038/s41587-023-02092-0
[2] Chiesa, Robert et al. “Base-Edited CAR7 T Cells for Relapsed T-Cell Acute Lymphoblastic Leukemia.” The New England journal of medicine vol. 389,10 (2023): 899-910. doi:10.1056/NEJMoa2300709
[3] WUCART7 1001 Phase 1/2 Dose-Escalation/Dose-Expansion Study of Anti-CD7 Allogeneic CAR-T Cells (WU-CART-007) in Relapsed or Refractory (R/R) T-Cell Acute Lymphoblastic Leukemia/ Lymphoblastic Lymphoma (T-ALL/LBL). Retrieved January 24, 2024 from https://wugen.com/wp-content/uploads/2023/12/2023-ASH-WUCART7_FINAL.pdf
[4] Wellhausen N, OConnell RP, Lesch S, Engel NW, Rennels AK, Gonzales D, Herbst F, Young RM, Garcia KC, Weiner D, June CH, Gill SI. Epitope base editing CD45 in hematopoietic cells enables universal blood cancer immune therapy. Sci Transl Med. 2023 Sep 20;15(714):eadi1145. doi: 10.1126/scitranslmed.adi1145. Epub 2023 Sep 20. PMID: 37651540; PMCID: PMC10682510.
[5] Casirati G, Cosentino A, Mucci A, Salah Mahmoud M, Ugarte Zabala I, Zeng J, Ficarro SB, Klatt D, Brendel C, Rambaldi A, Ritz J, Marto JA, Pellin D, Bauer DE, Armstrong SA, Genovese P. Epitope editing enables targeted immunotherapy of acute myeloid leukaemia. Nature. 2023 Sep;621(7978):404-414. doi: 10.1038/s41586-023-06496-5. Epub 2023 Aug 30. PMID: 37648862; PMCID: PMC10499609.
声明:本文旨在于传递行业发展信息、探究生物医药前沿发展。文案内容仅表率作者观点,并不表率医麦客立场,也不形成任何价值判断、投资意见或医疗指点,如有需求请咨询专业人士投资或前往正规医院就诊。
点点“分享”、“点赞”和“在看”,给我充点儿电吧~返回外链论坛:http://www.fok120.com/,查看更加多
责任编辑:
|