|

作者:Jerry
导读:食管鳞状细胞癌(ESCC)是一种发病率高、病死率高、预后差的消化道恶性肿瘤。虽然包含手术、化疗和放疗在内的联合治疗持续进步,但食管鳞癌的靶向治疗仍不发达。
5月5日,南京医科大学科研团队在期刊《Advanced Science》上发布了题为“Development of a Specific Aptamer-Modified Nano-System to Treat Esophageal Squamous Cell Carcinoma”的科研论文,本科研介绍了ESCC特异性DNA适配体以及一种创新的适配体修饰纳米系统,用于靶向药品和基因递送,以有效控制ESCC。

https://onlinelibrary.wiley.com/doi/10.1002/advs.202309084
科研背景
01
食管癌是癌症关联死亡的第六大平常原由。值得重视的是,中国约95%的食管癌病例被诊断为食管鳞状细胞癌(ESCC)。这种亚型拥有高死亡率和不良预后。ESCC的常规治疗办法包含手术、化疗、免疫疗法和放疗,以及它们的组合。然而,这些全身治疗办法难以区分正常细胞和癌细胞,引起非特异性细胞毒性和随后的副功效。这些药品的疗效进一步降低,由于其靶向能力不足,在ESCC肿瘤内的药品释放亦不一致。因此呢,ESCC的总体五年存活率仍然非常低,小于20%。这凸显了迫切必须研发更有效的ESCC特异性工具,以改善食管癌治疗结果的必要性。
纳米药品递送系统(NDDS)做为一种要紧的药品载体,因其在癌症治疗中的独特优良而备受关注。这些优良包含加强药品溶解度、加强药品在肿瘤组织内的分布、降低细胞毒性、穿越生物屏障的能力以及联合用药的可能性。重要是,经过将NDDS附着在肿瘤特异性细胞表面受体上,能够放大药品递送的效能和特异性。经过修饰的NDDS只靶向恶性细胞,而对健康细胞没害,从而加强了治疗效果。这里基本上,科研人员引入了天然蛋黄脂纳米载体(EYLNs)。该载体拥有较高的药品负载能力、延长的身体循环时间、经过加强渗透和保存(EPR)效应增多药品积聚以及改善细胞内渗透等优点,同期保持高生物相容性。它有望有效将化疗药品和核酸药品直接传送至肿瘤部位。
科研亮点
02
科研人员经过蛋白质印迹、实时细胞分析(RTCA)、流式细胞术和侵袭实验评定了EA1-修饰的PTX/siEFNA1-装载纳米药品对KYSE-150细胞的控制效果。经过EA1修饰明显加强了siEFNA1的有效递送,从而明显降低了ESCC细胞中的EFNA1表达。另外,将KYSE-150细胞暴露于各样纳米药品和PTX后发掘,siEFNA1递送加强了PTX控制KYSE-150细胞增殖、迁移、侵袭和加强细胞凋亡水平的能力。EA1修饰后效果更加明显。这显示EA1能够加强纳米药品的结合效率,从而产生更强的抗肿瘤效果。
科研人员采用带有荧光素酶标记的KYSE-150细胞创立了皮下食管鳞状细胞癌小鼠肿瘤模型。在第35天,采用五联疗法后,治疗组小鼠的肿瘤体积显著减小。与PBS组(350 mm3)相比,仅增长100 mm3,表示出明显差异。这显示siEFNA1有潜能控制肿瘤生长。图1(c-g)中的观察结果表示,与其他治疗相比,在EYLNs中加入PTX和siEFNA1的组合效果最佳,引起肿瘤生长最小化。重要的是,引入EA1修饰进一步优化了这种控制功效。虽然EYLN-PTX/siEFNA1已然能够有效地控制肿瘤生长,但EA1-修饰的版本进一步将肿瘤体积和重量减少了约50%。这显示联合治疗相针对单一治疗拥有显著的优良。另外,采集肿瘤组织并用转移酶dUTP末端标记(TUNEL)和Ki67的免疫组织化学(IHC)进行染色,对TUNEL和Ki67的特异性染色图像和定量分析表示,EA1-EYLNs-PTX/siEFNA1极重地控制了细胞增殖并促进了细胞凋亡。用EA1-EYLNs-PTX/siEFNA1治疗的小鼠表现出显著的细胞凋亡诱导效应,这显示其拥有强大的抗癌和生长控制功效。这与体外抗肿瘤活性评定中观察到的积极结果相吻合。
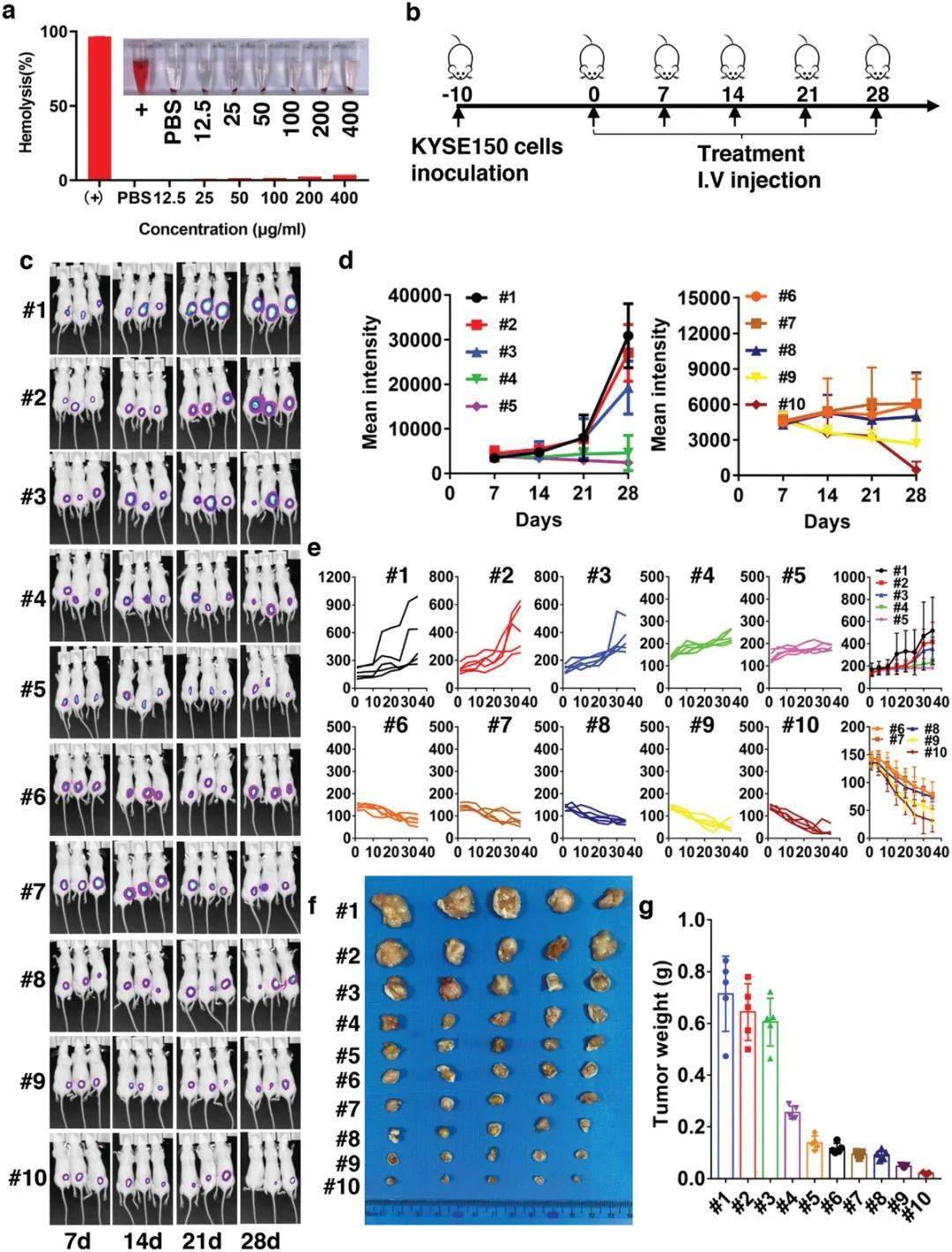
图1:EA1-EYLNs-PTX/siEFNA1在KYSE-150荷瘤小鼠身体ESCC抑癌效果
科研结论
03
总之,本科研结果显示,经过适配体修饰的纳米系统有望实现对肿瘤的更有效靶向递药和递送基因。这为食管鳞状细胞癌(ESCC)靶向治疗供给了潜在的靶向工具,为有前途的转化和应用开辟了途径。
参考资料:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202309084
注:本文旨在介绍医学科研发展,不可做为治疗方法参考。如需得到健康指点,请至正规医院就诊。
热门·直播/活动
|