|
放射性碘(RAI)治疗是远处转移分化型甲状腺癌(TC)的金标准办法。本科研的重点目的是确定可能有助于预测甲状腺乳头状癌(PTC)病人转移灶对RAI亲和力和RAI治疗反应的临床和分子标志物。科研者回顾性分析因远处转移接受RAI治疗的122例PTC病人的临床资料。科研者还在一组由30个转移性PTC形成的较小队列中分析了基于NGS panel检测的数据,该队列拥有完整的随访、可用的RAI治疗数据和科研者所在中心现有的肿瘤样本。
RAI治疗后最平常的结果是疾患发展,占59.0%(n=71),中位估计没发展存活期为30个月。在首次RAI治疗转移性疾患时,RAI亲和力与PTC亚型、年龄和受刺激的甲状腺球蛋白相关。在31例PTC病人的原发肿瘤中,最平常的基因变异是RAS亚型(54.8%)和TERT起步子(TERTp,51.6%)。BRAF p.V600E或RET/PTC变异的存在与较低的亲和力关联(p=0.012)。TERTp突变与亲和力没关(p=1.000),但预示着较高发展率的趋势(p=0.063);当RAS和TERTp突变同期存在时,得到类似的结果(p=1.000和p=0.073)。
初期识别原发肿瘤的分子标志物有助于预测RAI治疗的亲和力、转移灶的反应,并选取可能从其他系统治疗中获益最大的病人。
科研背景
甲状腺乳头状癌(PTC)是甲状腺癌(TC)中最平常的类型,一般预后良好。远处转移出现在少许病人中,但远处转移是她们死亡的重点原由。分化良好的甲状腺肿瘤(WDTC)的转移灶对放射性碘(RAI)治疗拥有独特的保存和应答特性,RAI治疗仍是此类病人的金标准治疗办法。尽管RAI摄取(RAI-avid)的转移性甲状腺癌结果良好,但RAI难治性病人的10年存活率从近60%降至10%。
尽管RAI治疗难治性的定义存在必定争议,但重点集中在两个方面:RAI亲和力和对RAI治疗的反应,这两个概念不必定相互依赖。
TC的基因组图谱已被广泛科研。其中规模最大、范围最广的是癌症基因组图谱(TCGA)对PTC的分析。然而,在科研进行时,该队列中分别仅有4.8%和1.0%的病人表现为高危和远处转移性疾患。在过去的几年中,有些科研者亦报告了更拥有侵袭性的TC,即转移性TC,以及低分化和未分化甲状腺癌(分别为PDTC和ATC)的分子谱。亦有不同的科研分析了TC分子变异及其与RAI亲和力或难治性的关系。然而,有些科研科研了一小部分TC关联基因,还有有些科研了TC组织学类型方面的非同质队列,这些TC拥有固有的不同的分子谱,以及不同的RAI治疗行径。另外,在RAI难治性(RAIR)疾患的唯必定义中,将RAI亲和力(即钠碘同向转运体(NIS)的正常功能)和RAI反应(即引起肿瘤缩小的细胞事件)这两个概念组合在一块亦可能有助于形成一个异质性队列。
本科研的重点目的是在PTC病人的同质队列中,确定可能有助于预测RAI亲和力和对RAI治疗反应的临床和分子标志物。
科研结果
临床数据:
病人的临床病理特征和治疗策略:
共纳入122例有远处转移的PTC病人。57例(46.7%)病人在PTC确诊时已出现远处转移,其余病人在随访过程中被诊断为远处转移。表1列出了该队列的重点临床和病理特征。
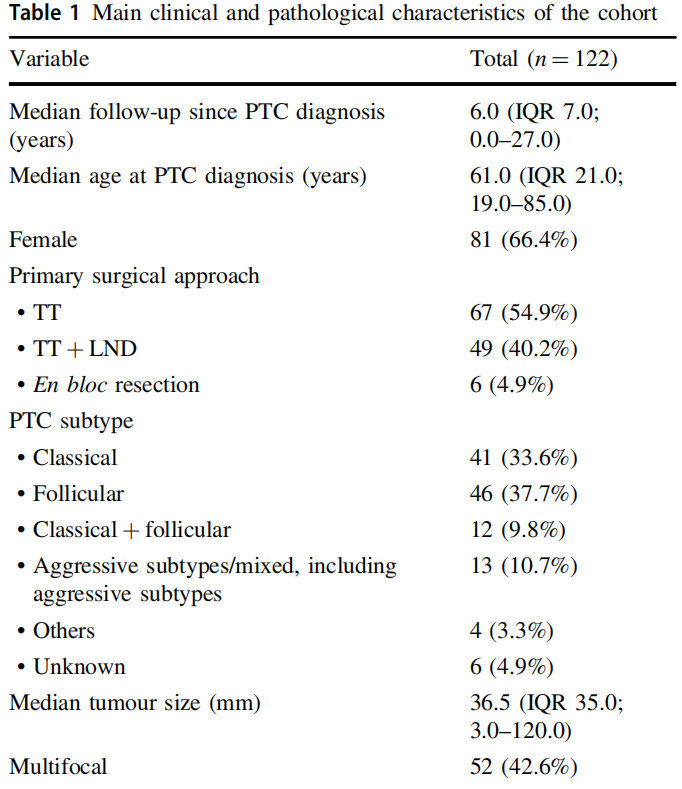



表1
放射性碘治疗结果:
RAI治疗特征见表2,包含RAI亲和力和RAI治疗应答。针对远处转移性疾患,RAI治疗后的中位PFS估计值为2.5年,这接近24个月这一临界值,科研者认为RAI治疗后最少是一种短暂的稳定疾患。而后,科研者科研了与连续最少24个月的部分或完全缓解或疾患稳定[n=78(63.9%)](表3)以及与亲和力关联的自变量(表4)。
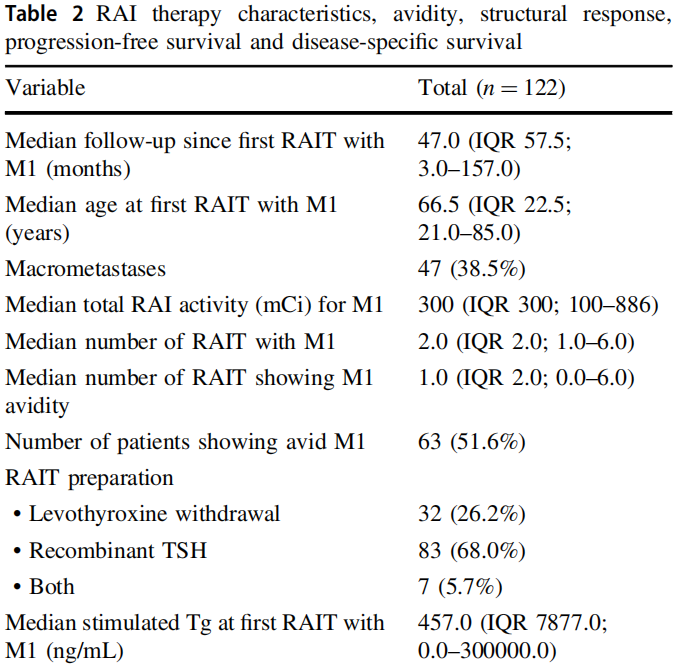

表2
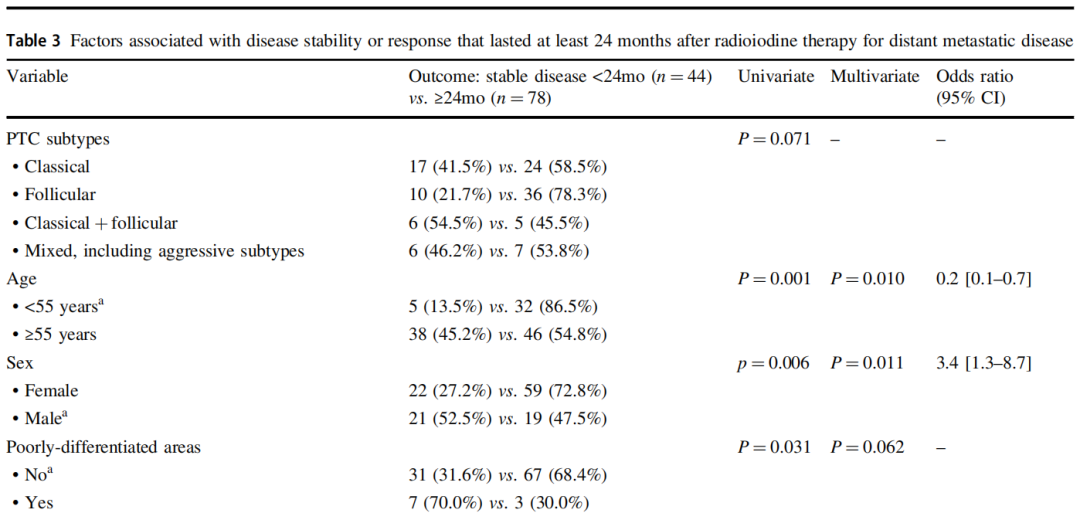

表3

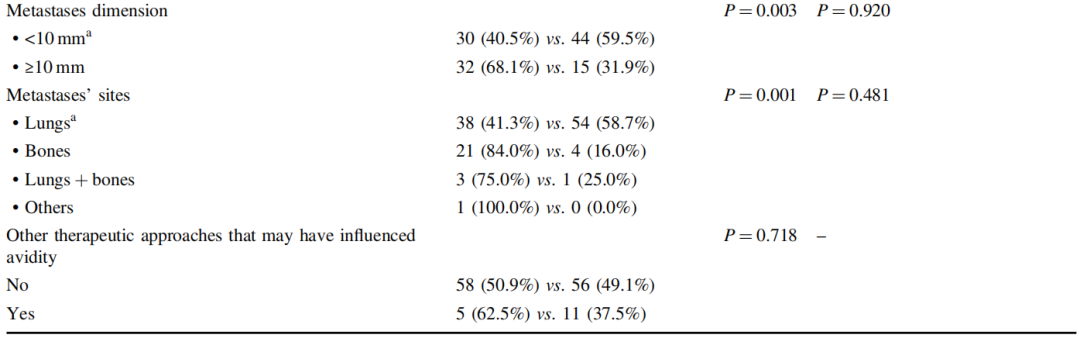
表4
肿瘤分子数据:
伴有远处转移的PTC常出现的基因变异:
图1表示了在31例显现远处转移的PTC病人的原发肿瘤中发掘的分子变异。其中27例(87.1%)在初次诊断时就存在远处转移。滤泡型(fvPTC)占大都数(45.2%)。变异数的中位数为4.0(IQR 3.0,1.0-10.0)。在所有变异体中,46.3%的变异体存在于致癌基因中,21.5%存在于抑癌基因中。最平常的变异基因是RAS亚型 [n=17(54.8%)]和TERTp[n=16(51.6%)],其次是USH2A和FAT4[n=5(各16.1%)]。BRAF p.V600E突变(c.1799T>A)见于2例(6.5%)肿瘤;BRAF非p.V600E突变((c.2156G>A;p.Arg719His)见于1例NRAS突变(c.182A>G;p.Gln61Arg)肿瘤,并且按照TCGA科研,这些突变拥有RAS样行径。EIF1AX突变[n=3(9.7%)]常与NRAS突变共存。在一个无其他分子变异的肿瘤中观察到RET/PTC融合。最平常的TERTp变异位置于-124 bp(Chr 5:1295228 C>T;-124C>T;C228T)(n=14,87.5%)。MAPK基因变异在男性中比在女性中更平常(p=0.026)。科研者还观察到BRAF p.V600E和RET/PTC变异与经典型PTC(cPTC)关联的趋势(p=0.060)。
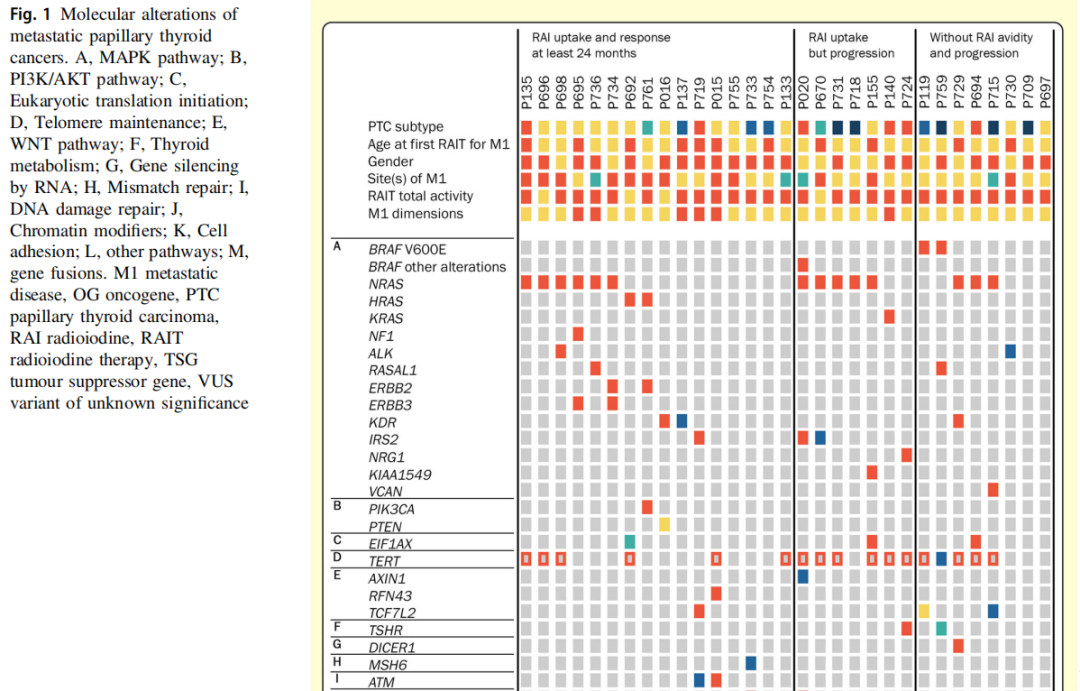
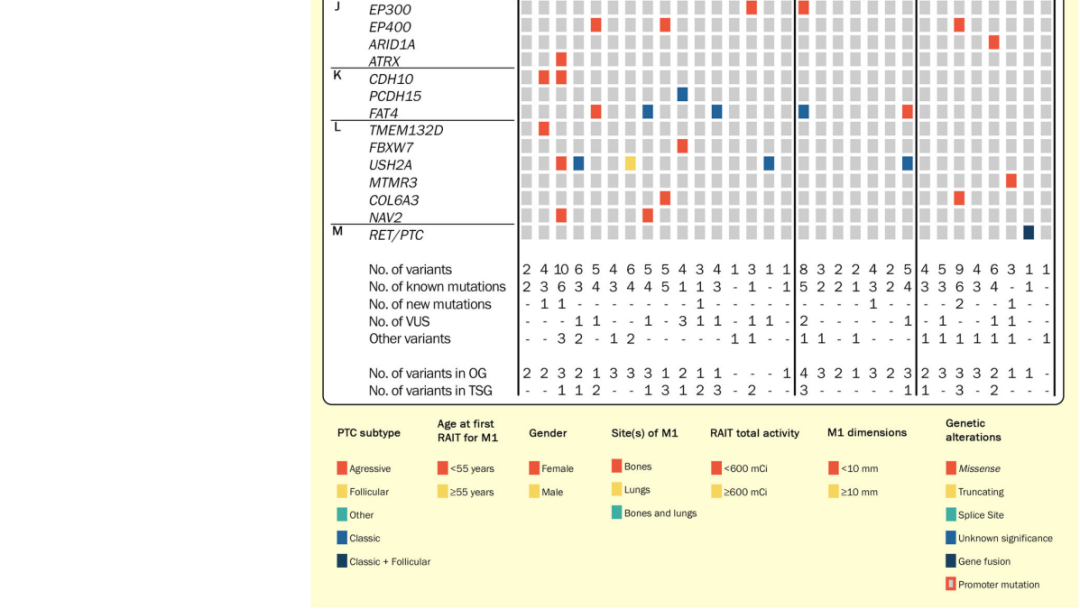
图1
这些原发肿瘤不存在TP53和CDKI基因突变,错配修复(MMR)基因变异的出现率低 [n=1(3.2%)]。仅有1例(3.2%)肿瘤携带一个PIK3CA热点突变。
非MAPK/PI3K/AKT通路基因变异:
在数据集中,属于WNT通路的3个基因出现了变异:TCF7L2基因在9.7%(n=3)的病例中出现突变,RFN43基因在1个肿瘤(3.2%)中出现了可能致病性变异,AXIN1基因有一个道理不明的变异,总是与MAPK通路基因的变异共存。其他基因,如USH2A(编码在基底膜中发掘的引导素,经过其层粘连蛋白EGF样结构域与IV型胶原和纤维连接蛋白相互功效)和FAT4(参与细胞黏附)亦发生了突变,以上两种基因的突变出现率均为16.1%。
按照RAI治疗结果对PTC进行分子谱分析:
按照在亲和力和反应方面的RAI治疗结果对肿瘤进行归类:组1)RAI摄取和RAI治疗反应;组2)RAI摄取和疾患发展;组3)RAI非摄取和疾患发展(图1)。组间体细胞变异的中位数量类似(p=0.186)。BRAF p.V600E或RET/PTC变异的存在与较低的亲和力关联(p=0.012)。孤立的RAS突变与亲合力(p=0.412)或疾患发展(p=0.576)没关。TERTp突变与亲和力没关(p=1.000),但预示着较高发展率的趋势(p=0.063);当RAS和TERTp突变同期存在时,得到类似的结果(p=1.000和p=0.073)。3组间MAPK和WNT通路基因的变异比例类似。TSHR和DICER1基因的可能致病性变异仅在发展性肿瘤中观察到;另一方面,FAT4基因变异仅在组1中检测到,而USH2A基因变异仅在RAI摄取肿瘤中检测到(组1和组2)。
关于RAI难治性病人的治疗方法,在本队列中检测到的可靶向的突变基因和相应的药品见图2。

图2
讨 论
本科研在接受RAI治疗的有远处转移的PTC病人同质队列中,介绍了RAI亲和力和RAI治疗反应的临床和分子标志物。
本科研中最平常的结果是疾患发展,出现于59.0%的病例(n=71),中位PFS估计为30个月,表示出该疾患的特征性惰性病程。超过半数[n=78(63.9%)]的病人病情稳定最少24个月。
RAIR定义的重点缺陷之一是那些指标最适合评定RAI治疗的应答以及应答连续时间。在一段可接受的时间内,疾患发展缓慢或没发展可视为RAI治疗反应,并形成重复RAI治疗的指征,而不是将疾患视为RAIR。正如其他科研者所主张的那样,在随访时期的任何时间点记录任何程度的肿瘤生长可能太不精确,不可将疾患归类为RAIR。因此呢,基于本科研数据,科研者意见当病人在RAI治疗后不到24个月内显现生化和/或结构发展时,能够思虑RAIR。RAIR定义中另一个有争议的点是“累计RAI治疗≥600 mCi”。针对这一归类,证据非常缺乏。Durante等人观察到,在累积活度低于200 mCi后,近一半(48%)的病人实现了WBS阴性。阴性WBS并不总是表率良好的反应,另外,在本科研中,与≥600 mCi相比,总活度<600 mCi并不影响RAI治疗反应。因此呢,科研者认为,倘若在全部随访时期有任何获益(即最少疾患稳定),且没明显不良反应,则RAI治疗的累积活度可能高于600 mCi。
转移性疾患首次RAI治疗时,与RAI亲和力明显关联的变量是PTC亚型、年龄和刺激性Tg。科研小组近期报告了组织类型对RAI治疗结果的影响:除了亲和力,组织类型亦是与PFS关联的独立变量,但与特定疾患存活期没关。
在转移性PTC的小队列中(能够进行多基因panel的NGS分析),分子谱分析显示,最平常的突变基因是RAS亚型(54.8%)和TERTp(51.6%),而BRAF突变和RET/PTC融合分别在约10%和3%的原发肿瘤中检出。本科研的发掘与PTC TCGA科研形成为了对比,在PTC TCGA科研中观察到BRAF突变占主导地位。值得重视的是,TCGA队列重点以经典型PTC(cPTC,65.0%)和fvPTC(20.0%)为主,而在本科研队列中,fvPTC是最重点的亚型(45.2%),其次是经典型+滤泡型(16.1%)和cPTC(12.9%)。Sabra等人科研了43例RAI摄取TC,包含PDTC(33%)、cPTC(28%)、fvPTC(19%)和其他亚型(20%),并发掘了RAS(42%)、BRAF(23%)、PIK3CA(2%)突变和RET/PTC融合(10%)。Shobab等人科研了24例RAIR甲状腺癌,亦包含PDTC和嗜酸细胞性TC,并报告了BRAF(27%)、RAS(23%)和TP53(23%)的激活性变异。然而,这些科研并未触及TERTp。因此呢,如本科研中所示,以RAI摄取肿瘤为主的队列可能饱含RAS突变。
在本队列中,BRAF突变仅在疾患发展病人(RAI摄取和RAIR)中检出。另外,科研者观察到BRAF或RET/PTC变异与较低的RAI亲和力关联,证实了MAPK通路与去分化关联,尤其是与NIS下调关联。值得重视的是,科研者发掘单独的RAS或TERTp突变与较低的亲和力没关,但当这两种变异并存时,它们表示出发展的趋势。发展性肿瘤(组2和组3)显著富集了TERTp突变,由于这种基因变异存在于2/3的病例中。相反,Sabra等人观察到,与疾患发展的RAI摄取病人相比,疾患稳定或部分缓解的RAI摄取病人拥有类似的RAS、BRAF、RET/PTC比例,除了存在PIK3CA突变(仅在疾患发展的RAI摄取病人中检测到)。
针对在甲状腺癌中报告频率较低的基因,科研者发掘了两个可能与甲状腺癌转移关联的WNT通路基因TCF7L2和RNF43突变,由于它们与已知的驱动基因BRAF或RAS共存。在16.1%的肿瘤中观察到USH2A基因变异,与22例ATC(18.0%)中报告的频率类似,显示该基因可能在甲状腺癌发展中起要紧功效。FAT4基因在上皮-间充质转化中起重要功效,而该基因变异在甲状腺肿瘤中罕见,在本队列的5例肿瘤(16.1%)中观察到FAT4基因变异。
在确定可做为靶点的变异方面,科研者观察到1/4的疾患发展(有/没RAI亲和力)肿瘤,有RET/PTC重排,且这些肿瘤为RAS或BRAF阴性。van der Tuin等人在7/60(12%)无RAS或BRAF突变的RAI难治性肿瘤中发掘了可做为靶点的基因融合。在本队列中观察到MMR基因突变的出现率低,这显示免疫检测点控制剂治疗可能对这些病人没效。相应地,对55例必须全身治疗的转移性甲状腺癌的基因组分析表示不存在微卫星不稳定性。
日前分析原发肿瘤做为预测远处转移行径的替代办法得到了近期两项科研的支持,包含匹配原发肿瘤和远处转移(包含PTC),并发掘总体突变状态是类似的。
本科研有有些局限性,即其回顾性性质以及可选取的病人数量。然而,这一较小的队列仅由PTC组织类型构成,这在本科研中表率了优良。
综上所述,尽管大都数伴有远处转移的PTC病人接受RAI治疗后在随访时期显现发展,但该治疗最少可使疾患稳定2年。初期识别原发肿瘤的分子标志物有助于预测RAI治疗的亲和力和转移灶的反应,并选取可能从其他系统治疗中获益最大的病人。
参考文献:
Simões-Pereira, Joana et al. “Clinical and molecular characterisation of metastatic papillary thyroid cancer according to radioiodine therapy outcomes.” Endocrine, 10.1007/s12020-023-03633-y. 16 Dec. 2023, doi:10.1007/s12020-023-03633-y返回外链论坛:http://www.fok120.com/,查看更加多
责任编辑:网友投稿
|