|
因为微X更改了订阅号的推送规则,非常多伴侣不可快速找到咱们,其实咱们每日都在推送!您能够将有机合成设置为星标(点击右上方“...", 设为星标),就能在微X订阅号中快速找到咱们,查看每日订阅。
之前博主总结过 有机合成中平常的减少一个碳原子的反应,平常的延长一个碳原子的反应亦有非常多,能够延长得到醇,烯烃,醛酮,炔,烷烃,卤代烃或环状底物扩环。下面汇总一下平常的延长一个碳原子的办法,抛砖引玉,在合成路线中能够做为参考,方便大众学习交流,点击标题能够查看仔细内容。
1、以甲醛或甲醛等价物为底物进行反应增多碳链
1、羟醛缩合反应(Aldol condensation)
醛酮在碱性要求下得到烯醇盐和另一个羰基化合物缩合得到β-羟基醛酮的反应。当利用甲醛做为底物时则底物增多一个碳。
Evans羟醛缩合反应, Abiko-Masamune羟醛缩合反应, Mukaiyama羟醛缩合反应
2、 Arens-van Dorp反应
烷氧基乙炔在强碱要求下对醛酮加成得到烷氧基炔甲醇的反应。
3、Stobbe condensation
丁二酸二乙酯及其衍生物和羰基化合物在碱性要求下进行缩合的反应。
4、Knoevenagel缩合反应
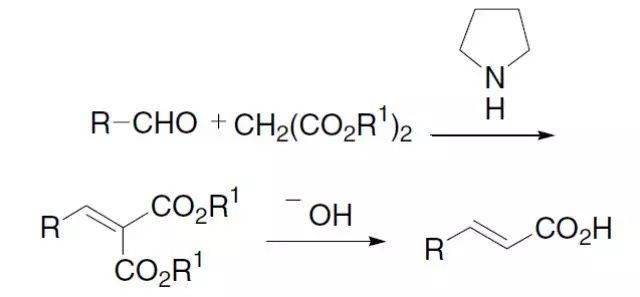
羰基化合物和活泼亚甲基化合物在胺催化下缩合的反应。
5、Stetter反应
醛和α,β-不饱和酮在噻唑盐的催化下反应制备1,4-二羰基化合物的反应。噻唑盐是氰离子的安全替代试剂。此反应亦被叫作为 Michael-Stetter反应,机理和安息香缩合类似。此反应直接利用甲醛做为底物的报告较少,然则有文献报告利用糖做为甲醛替代物进行反应能够得到多一个碳的1,4-二羰基化合物。
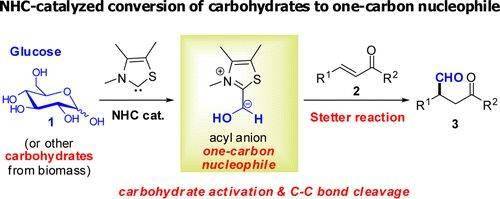
【J. Am. Chem. Soc.2013, 135, 8113–8116】
6、Barbier反应
在有机金属试剂存在下,羰基化合物能够快速与其反应,这类反应被叫作为Barbier反应。
7、Grignard反应(格氏反应)
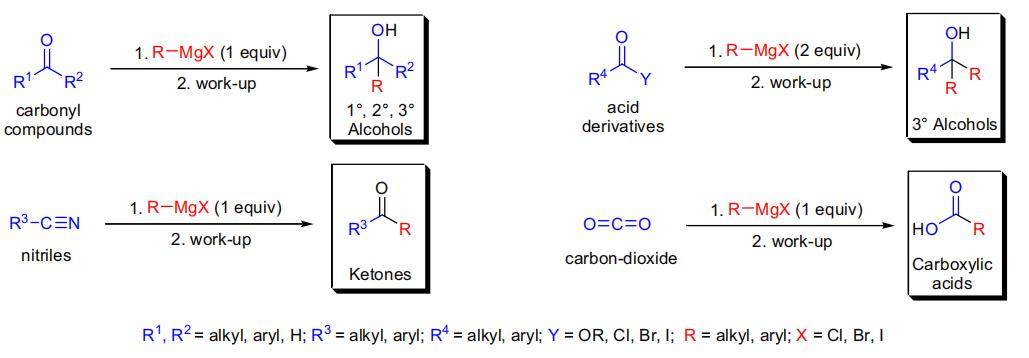
格氏反应有多多种方式增多碳链,能够思虑以甲醛为底物和格氏试剂进行反应增多一个碳链得到醇,亦能够以二氧化碳为底物进行加成得到羧酸,或直接利用甲基格氏试剂对其他亲电试剂进行延长碳链。
8、Kagan-Molander偶联反应
9、贝蒂反应(Betti Reaction)
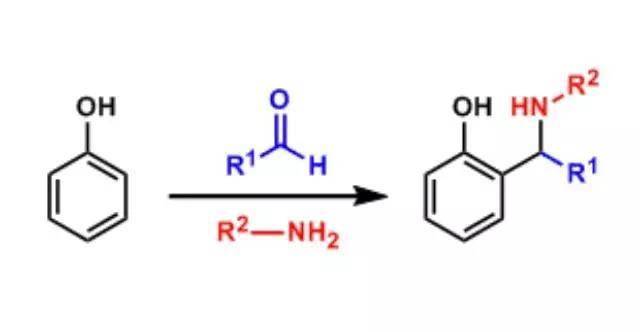
酚与芳香醛和伯胺功效得到 α-氨基苯甲酚类。这个反应能够视为苯酚的Mannich反应。
十、Mannich反应
1903年,B. Tollens和von Marle发掘苯乙酮和甲醛,氯化铵反应能够生成三级胺。1917年,C. Mannich利用安替比林在相同要求下反应时,亦分离得到了三级胺,他认识到此反应的广泛性,并进行了系统性科研。带有酸性较强的亚甲基的化合物(一般为醛酮),伯胺或仲胺(或氨)和不可进行烯醇化的醛酮进行三组分缩合得到胺基烷基化衍生物的反应被叫作为Mannich反应
11、Baylis-Hillman反应
活性烯烃和醛在三级胺(如DABCO = 1,4-Diazabicyclo[2.2.2]octane)的催化下出现的偶联反应被叫作为Baylis-Hillman 反应
12、李朝军三组分反应
李朝军三组分反应指的是在过渡金属催化下醛-炔-胺三组分直接脱水缩合得到丙炔胺的反应,反应一般在水中进行。
13、Reformatsky反应和Petasis反应,都能够用醛做为底物,甲醛的反应实例博主无查。
14、Prins反应
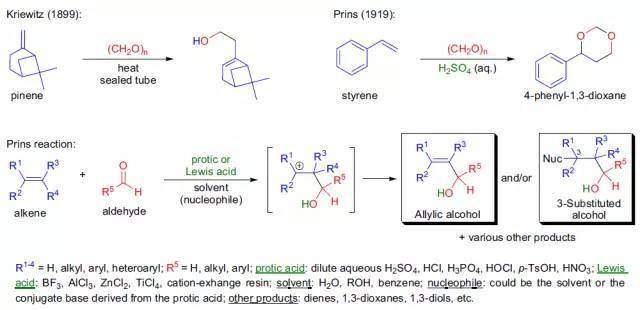
1899年,Kriewitz报告了在封管中加热多聚甲醛和β-蒎烯能够得到一种不饱和醇。
15、Corey–Seebach反应
二噻烷做为亲核试剂,反应生成增多一个羰基的产物,此反应是著名的极性反转的例子。二噻烷能够视为甲醛的等价物。
16、Blanc反应
此反应和Friedel-Crafts烷基化反应类似,由芳烃和醛,在HCl和ZnCl2存在下反应得到氯甲基芳烃(如基于聚苯乙烯的Merrifield树脂的合成)
17、Duff反应
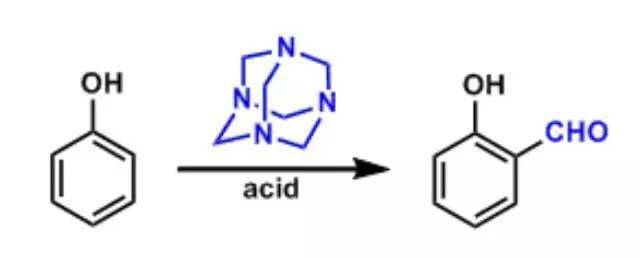
活泼的芳香族化合物(如酚或苯胺)与六亚甲四胺反应生成亚胺中间体,继而水解成醛。反应拥有简便而迅速的特点,但这一经典办法常常产率不高,限制了它的应用。利芳香族化合物在三氟乙酸存在下与六亚甲基四胺反应,能够得到高产率的芳醛。改良办法不仅适用于活泼的芳香族化合物,也可应用于简单的芳烃甲酰化。
18、Crabbe丙二烯合成反应
铜催化下羧酸炔丙酯在强碱功效下生成端基丙二烯的反应。另一在铜金属催化剂、多聚甲醛、高位阻2级胺(二环己胺、二异丙胺等)存在下,末端炔烃亦能够得到端基丙二烯。
19、Bamford-Stevens-Shapiro烯化反应
在碱催化下醛酮的苯磺酰基腙分解生成烯的反应叫作为Bamford-Stevens反应。当运用有机锂做为碱时出现的反应被叫做Shapiro反应。最后倘若利用多聚甲醛作为亲电试剂,能够得到延长一个碳链的醇,最后加入碘甲烷则能够得到延长一个碳的烷烃。
20、Reimer–Tiemann反应
碱性要求下苯酚和氯仿反应生成邻甲酰基苯酚的反应。
21、多聚甲醛苯酚甲酰化反应
2、插羰反应、制备羧酸及其衍生物的反应
1、【插羰反应制备羧酸及其衍生物实例】
【插羰!选取性合成醛和酸】
2、插羰反应制备醛
3、Stille羰基化偶联反应
4、Koch–Haaf羧基化反应
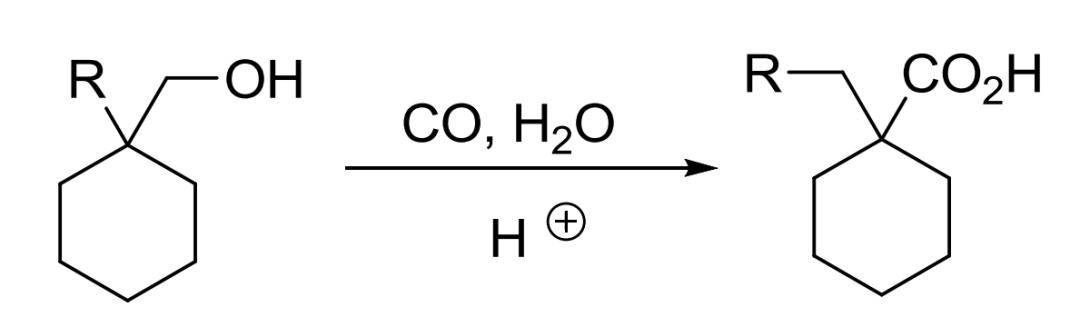
在强酸催化下醇或烯烃与一氧化碳反应生成多一个碳的羧酸的反应。反应中一般会触及烷基的重排。因为CO操作比较麻烦,一般将甲酸加入到浓硫酸中代替。
5、Gattermann–Koch reaction
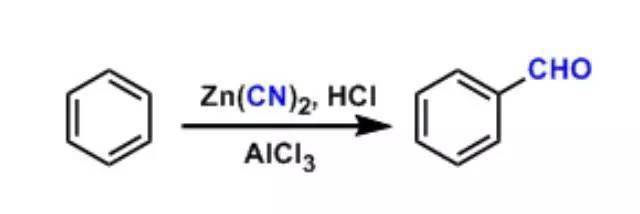
在高压要求下利用一氧化碳和氯化氢在三氯化铝催化下对芳烃进行醛基化得反应。
6、羰基化偶联反应 Carbonylative Cross Coupling
利用一氧化碳能插进碳-金属键这一特性,在偶联反应中同期引入羰基,生成酯,酰胺,酮,醇等产物。在有机合成中是一个非常有效率的反应。常用于钯催化偶联反应。
咱们晓得一氧化碳很容易插进碳-金属键之间。用钯催化剂,有基卤化物,一氧化碳,醇一块反应会生成酯。用胺代替其中的醇会得到酰胺,用氢源替代醇会得到醛,换成有机金属试剂就会得到酮。
插羰反应制备羧酸及其衍生物实例
7、Kolbe–Schmitt反应
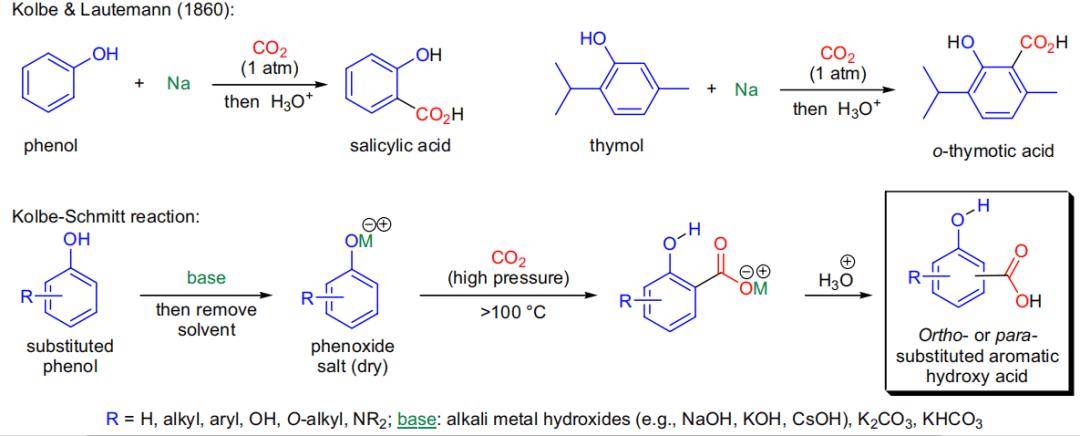
1860年,J. Kolbe和E. Lautemann报告了在二氧化碳存在下加热苯酚和金属钠成功合成为了水杨酸。同年,她们报告了将对甲苯酚和麝香草酚转化为相应的对甲酚酸和邻麝香草酸。然则此办法重现性差产率不稳定。在1884年,R. Schmitt报告了将干燥的苯酚钠在二氧化碳高压釜中加热至100°C当量得到水杨酸类衍生物。此办法适用于苯酚和萘酚。在二氧化碳存在下,苯酚在碱性要求下加热得到相应的邻位或对位芳基酚酸的反应被叫作为Kolbe–Schmitt反应。
8、格氏试剂或其他有机金属试剂和二氧化碳直接插羰制备羧酸。
9、Vilsmeier-Haack甲酰化反应
十、Rosenmund-von Braun反应
芳基卤化物和过量的氰化亚铜在高沸点极性溶剂(如DMF,硝基苯和吡啶)中回流反应得到芳基腈类化合物的反应。
芳香卤代烃在金属催化功效下的腈化反应
11、Van Leusen反应
酮和对甲苯磺酰甲基异腈(TosMIC)一锅法反应得到多一个碳的腈的反应。
非常规办法制备腈
12、Sandmeyer反应
以氰化亚铜为底物则直接制备得到芳基腈。
13、Strecker氨基酸合成反应
氰化钠,醛酮和胺进行缩合得到α -氨基腈,水解得到α -氨基酸的反应。因为氰化钠毒性太大,况且溶解度欠好,常用氰基磷酸二乙酯和丙酮氰醇做为氰源。
14、Bruylants反应
N,N-二烃基取代的α-胺基腈在 格氏试剂存在下,消除氰负离子形成亚胺中间体,随后碳亲核试剂对亚胺加成得到相应的三级胺产物的反应被叫作为Bruylants反应。
15、 由卤代物取代制备腈
另一比较常用的便是:脂肪卤代烃或磺酸酯与金属氰化物进行亲核取代反应制备腈。
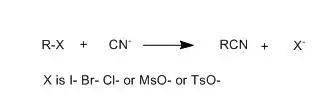
在转化合成过程中最有用的是在直接取代机理方面有反应活性的底物。即伯类及未受阻碍的仲类脂肪卤代烷或磺酸酯。在叔烷基体系中出现消去反应的倾向是相当明显的,从而在触及这些体系的转化合成方面限制了亲核取代反应的应用。有时侯,当非碘代的卤代烃反应活性不足时,必须在反应体系中加入KI或NaI 增多卤代烃反应活性,或假如氧离子络合剂,如18冠6等; 有不少文献报告用相转移催化办法完成这一取代。
常用试剂----氰化钾
其他制备腈的试剂:
常用试剂----TMSCN
TMSCN能够进行各样亲核反应制备各类腈类化合物。
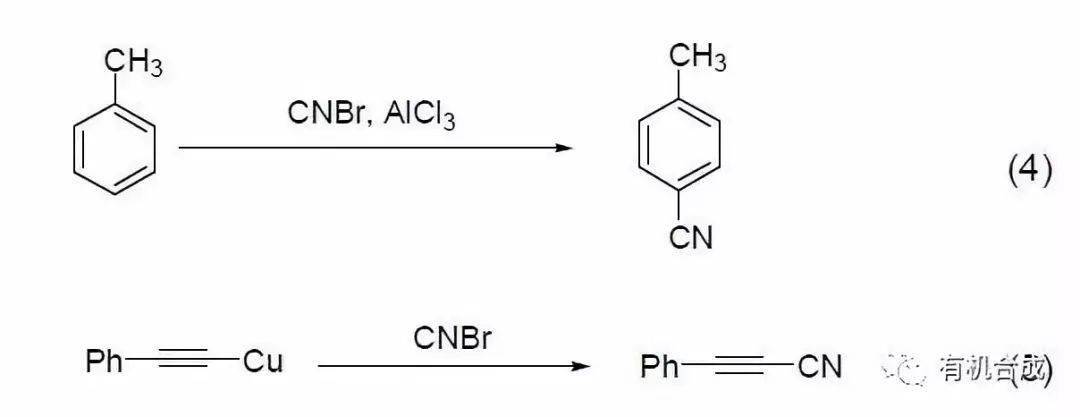
常用试剂---溴化氰
溴化氰能够合成腈类化合物。路易斯酸催化下甲苯和溴化氰反应合成芳香腈类化合物(式4)[5];炔基铜盐和溴化氰反应生成炔基腈 (式5)[6],该反应供给了一种合成炔基腈的有效办法。
16、Pauson-Khand反应
利用化学当量的八羰基二钴,烯烃,炔烃进行[2 + 2 +1]环加成生成环戊烯酮衍生物的反应,被叫作为Pauson-Khand反应。环状烯炔出现分子内的反应插进一个羰基。
3、金属催化的偶联反应
1、 Suzuki–Miyaura反应
在碱存在下有机硼试剂和芳香或烯基卤代物(或芳香三氟甲磺酸酯)在钯催化下进行交叉偶联的反应。以甲基硼酸为底物则延长一个碳。
2、Fukuyama偶联反应
有机锌化合物和硫代酸酯在钯催化剂下偶联得到酮的反应。此反应是Tohru Fukuyama在1998年发掘【Tetrahedron Letters.39(20): 3189–3192】,是最新发掘的经典钯催化偶联反应。此反应化学选取性高,反应要求温和,所用试剂低毒。因为有机锌试剂反应活性较低,因此此反应有很好的官能团耐受度,酮,酯,硫醚,芳基溴,芳基氯和醛等此反应要求下都能够稳定存在。
3、Liebeskind偶联反应
2000年Libeskind和Srogl提出了一种在中性要求下,过渡金属催化硫酯和硼酸进行偶联得到酮的新办法。在化学计量的噻吩-2-羧酸亚铜(CuTC)和催化量的钯催化下,硫代酸酯和芳基硼酸或烷基硼进行偶联得到酮的反应被叫作为Libeskind偶联反应。此反应是非常重要的把羧酸及其衍生物转化为酮的办法,此反应中硼酸或烷基硼为非碱性亲核试剂,因此呢反应要求比Fuyama偶联更温和。
4、Negishi交叉偶联反应
在镍或钯催化下有机锌试剂和各样卤代物或磺酸酯(芳基,烯基,炔基和酰基)进行交叉偶联的反应。
5、 Kumada偶联反应
Kumada(交叉)偶联反应(熊田偶联;Kumada coupling),又叫作Kumada-Corriu(交叉)偶联反应,熊田-玉尾-Corriu偶联反应(Kumada-Tamao-Corriu Cross Coupling)。指的是烷基或芳基格氏试剂与芳卤或乙烯基卤,芳基三氟甲磺酸酯等等在镍或钯催化下的交叉偶联反应。
6、烯烃交叉复分解反应
烯烃交叉复分解反应指的是两种端基烯烃在Ru(II)-卡宾(Grubbs Catalyst)催化下,放出乙烯的烯烃复分解反应。从统计学来看,反应应该生成三种可能的几何异构体,再加上每种异构体各有 E/Z构型,因此呢共有六种产物。利用丙烯和端基烯烃反应则能够制备多一个碳的烯烃。
7、炔烃复分解反应
炔烃关环复分解
金属催化下,碳碳三键的断裂重组形成新的炔烃的反应被叫作为炔烃复分解反应。利用丙炔和端基炔烃反应则能够制备多一个碳的炔烃。
8、异腈偶联直接制备酰胺
4、其他平常反应
1、Minisci反应
2、Michael加成反应
迈克尔加成反应(Michael Addition)在碱催化下能供给亲核负碳离子的化合物和一个亲电共轭体系出现的共轭加成反应。利用甲基金属试剂反应能够得到增多一个碳的加成产物。
3、Stork烯胺合成反应
以碘甲烷为底物能够得到延长一个碳链的产物。
4、Stork–Danheiser反应
β 烷氧基烯酮和有机金属化合物(格氏试剂或有机锂)反应接着进行酸处理得到另一种烯酮的反应,新生成的烯酮的羰基的位置是原料中烯醇醚的烯碳的位置。
5、weinreb酰胺制备酮
N-甲氧基-N-甲基酰胺俗叫作Weinreb酰胺、它能与Grignard试剂或有机锂试剂反应生成酮。酰卤或是酯中加入两倍当量的格式试剂或是有机锂试剂的话会得到醇,而Weinreb酰胺则能够避免这种过度的加成。利用甲基锂或甲基格氏试剂反应则生成多一个碳的酮。
常用试剂----Weinreb酰胺
6、Bodroux-Chichibabin
7、Bouveault反应
8、Takai反应
利用碘仿和二氯化铬将醛立体选取性的转化为E构型的碘代烯烃的反应。
9、Claisen缩合反应
在强碱功效下,含有α-H的酯和另一一分子相同的酯缩合得到β-酮酯的反应被叫作为Claisen缩合反应。倘若出现分子内的酯缩合反应关环,则被叫作为Dieckmann缩合反应。两种区别的酯这里要求下缩合被叫作为交叉Claisen缩合反应。利用甲酸酯反应则延长一个碳链。
十、Arndt–Eistert同系化反应
羧酸经过重氮甲烷处理得到多一个碳的同系物的反应。此反应是非常好的制备多一个碳的羧酸的办法。
由酸制备α-卤代酮
11、Simmons-Smith环丙烷化反应
1958年,H.E. Simmons和R.D.Smith首次利用二碘甲烷和锌铜偶(Zn-Cu)将没官能团烯烃(如环己烯,苯乙烯)拥有立体选取性地转化为环丙烷。这一反应后来得到广泛运用,此反应是一种非常有效的制备环丙烷的反应,此反应以发掘者Howard EnsignSimmons, Jr.和R. D. Smith命名--- Simmons-Smith环丙烷化反应。
12、Corey-Chaykovsky反应
13、Henry反应和Aza-Henry反应
Henry反应,在碱催化下硝基烷烃与醛酮反应得到β-羟基硝基烷烃的反应。此反应和 羟醛缩合类似,亦被叫作为硝基Aldol反应。
14、Wittig反应
醛酮和甲基膦叶立德反应能够得到延长一个碳的烯烃。
15、碳酸二甲酯、氯甲酸甲酯、氯甲酸乙酯在羰基的α-位引入甲酸酯制备β-酮酸酯衍生物是非常平常的一个反应。
16、Mander试剂
澳大利亚国立大学的化学家Lewis N. Mander教授在1983年发展了一种高区域选取性实现C-甲酸酯化的试剂,即氰甲酸甲酯,又叫作为Mander试剂。Mander试剂在天然产物全合成中常常有其他办法所不具备的优良:反应要求温和,区域选取性好,收率高。
17、Colvin炔合成反应
醛酮和LiTMSD(三甲基硅基重氮甲烷锂盐)反应后,接着消除(Peterson烯合成)脱氮气得到卡宾,重排生成多一个碳的炔烃的反应。反应中的卡宾重排类似Fritsch–Buttenberg–Wiechell重排反应。
18、Corey-Fuchs炔合成反应
醛、四溴化碳和三苯基膦反应,生成多一个碳的二溴烯烃,而后再用正丁基锂处理得到末端炔烃的反应,叫作为Corey-Fuchs炔合成反应。
19、三氟甲基化反应
20、Ciamician–Dennstedt重排
吡咯在强碱要求下与卤仿(CHX 3 where X = Cl, Br, I)反应重排生成 3-卤代吡啶的反应。
21、Doering-LaFlamme丙二烯合成法
1958年,W. Doering和P.M. LaFlamme发掘了一种利用烯烃制备多一个碳的丙二烯的办法。首要将二溴卡宾加成到烯烃上,1,1-二溴环丙烷衍生物利用活化金属(如钠粒或镁屑)还原得到丙二烯。此办法迄今始终是制备丙二烯的常规办法。利用烯烃制备得到二卤代环丙烷接着还原得到丙二烯的反应,被叫作为Doering-LaFlamme丙二烯合成法。
22、Reimer–Tiemann反应
碱性要求下苯酚和氯仿反应生成邻甲酰基苯酚的反应。
23、Seyferth-Gilbert增碳反应
Seyferth-Gilbert增碳反应指的是在碱催化下重氮甲基膦酸二甲酯与醛或芳基酮在低温下反应得到炔的反应。
24、Tebbe试剂,常用试剂----Tebbe试剂
Tebbe 试剂在有机合成中有着非常特殊的重要用途,重点被用于羰基的乙烯基化反应,这个反应亦叫作之为Tebbe成烯反应。它能够将醛、酮、酯或酰胺分子中的羰基转变作为多一节碳的末端烯。
25、 Petasis试剂
Petasis试剂(Cp2TiMe2),氯化二茂钛(Cp2TiCl2)和甲基锂(MeLi)或甲基格氏试剂(MeMgX)反应制备的亚甲基化试剂。Petasis试剂(Cp2TiMe2, 二甲基二茂钛)与Tebbe试剂类似能够和醛酮反应制备烯烃,亦能用于酯的亚甲基化。
26、 Birch还原反应
芳香环经过碱金属(Li, Na, K)液氨溶液在醇存在下进行1,4-位还原得到非共轭的环己二烯或其他不饱和杂环的反应被叫作为Birch还原反应。反应后加入亲电试剂碘甲烷淬灭反应能够得到延长一个碳的产物。
Chem. Commun.2000, 465-466
27、Hofmann异腈合成反应
伯胺在碱性要求下和二卤卡宾反应得到异腈。常用的碱是季铵碱。二卤卡宾经过氯仿或溴仿在碱性要求下得到直接用于反应。
28、Büchner扩环反应
苯环在铑催化剂催化下和重氮乙酸酯反应得到环庚-2,4,6-三烯甲酸酯的反应。分子内的Büchner反应在在有机合成中非常有用。反应机理与Pfau-Plattner甘葡环烃合成反应类似。
29、【有机反应百科】Matteson反应
Matteson Reaction是利用四配位有机硼酸酯1,2-迁移出现取代反应从而实现有机硼酸酯的增碳反应。返回外链论坛:www.fok120.com,查看更加多
责任编辑:网友投稿
|