|
近年来,免疫肿瘤学科研方面的突破性发展带来了肿瘤攻击形式上的重大变革,其治疗效果表现优异,能够使以往实践显示手术、放疗、化疗和靶向治疗疗效欠佳的肿瘤出现持久性消退。以PD-1/PD-L1/CTLA-4等分子为表率的免疫检测点阻断(ICB)疗法是近年来免疫肿瘤学科研中的热门行业之一。
不外,日前的ICB治疗只对少许癌症病人有益。癌症抵抗和逃避免疫的两个重点机制是癌细胞表达控制分子引起的T细胞功能阻碍和MHC-I丢失引起的抗原呈递缺陷,即T细胞排斥。
一般,缺乏MHC-I的细胞,会被自然杀伤细胞(NK)识别并杀死。因此呢,疑问随之而来:为么MHC-I缺陷的肿瘤细胞不会被NK细胞杀死?
2024年4月23日,寻百会生物的联合创始人肖腾飞博士、刘小乐博士以及首席信息官胡熙浩博士做为一起通讯作者,在顶刊《Cell》上发布一篇名为《IGSF8 is an innate immune checkpoint and cancer immunotherapy target》的科研文案。(图1)

这项科研中,科研人员经过CRISPR筛选,发掘肿瘤表达的IGSF8经过与NK细胞上的人KIR3DL2和小鼠Klra9受体相互功效来控制NK细胞功能。IGSF8一般在神经元组织中表达,在体外或身体都不是细胞存活所必需的。在许多肿瘤中,会显现过表达并且与低抗原呈递、低免疫浸润和较差的临床结果关联。阻断IGSF8-NK受体相互功效的抗体在体外和身体均上调了NK细胞的杀伤功效。在同基因肿瘤模型中,抗IGSF8单独或与抗PD-1联合运用能够控制肿瘤生长。科研结果显示,IGSF8是一种先天免疫检测点,能够做为治疗癌症的靶点。(图2)
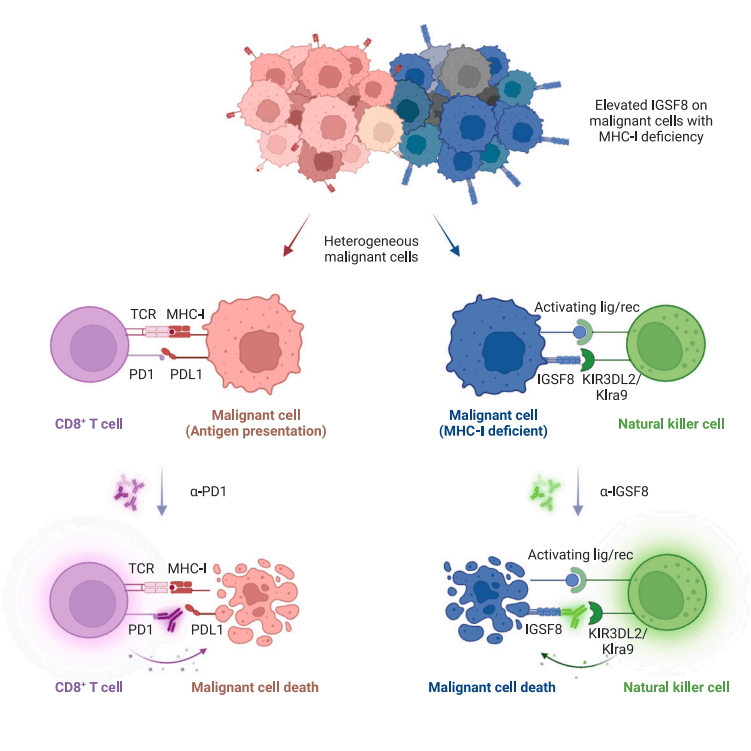
1、IGSF8与NK细胞
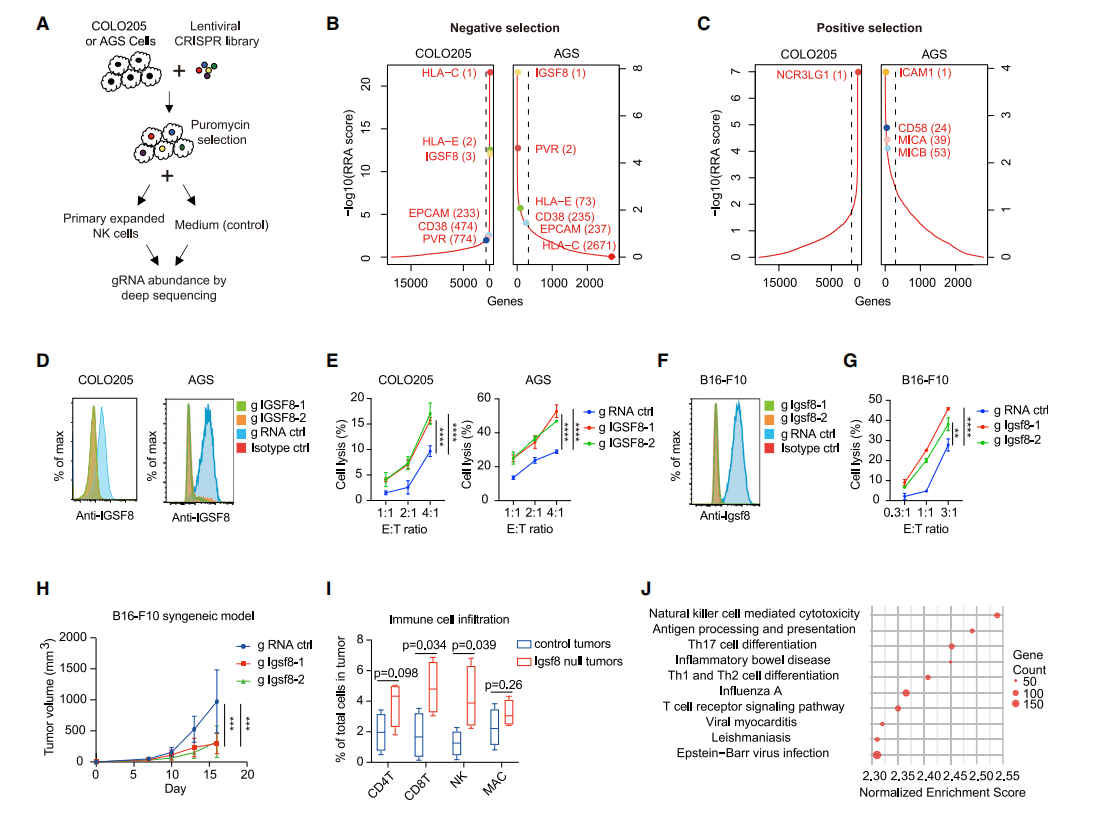
科研人员用MHC-I高表达的COLO205人结肠癌细胞系和MHC-I缺乏的AGS人胃癌细胞系进行了NK细胞共培养CRISPR筛选,鉴定影响NK细胞介导的癌细胞杀伤的基因。
负选取基因是NK细胞的控制基因,正选取基因是NK细胞的激活配体。除了预期的靶标外,IGSF8在两类细胞筛选中始终做为强负选取基因显现。IGSF8(亦被叫作为EWI-2、CD316、LIR-D1)是免疫球蛋白超家族EWI亚家族的成员,但很少有发布的科研直接探究IGSF8的功能。来自DepMap项目的在基线前提下(无免疫细胞)生长的数百种癌细胞系的CRISPR筛选显示,IGSF8对癌细胞存活无重大影响。
为了验证恶性细胞中IGSF8缺失能够加强NK细胞杀伤力的假设,科研人员敲除癌细胞系中的IGSF8,观察到原代NK细胞的杀伤明显增多,结合其他癌细胞实验,显示IGSF8在不同类型的癌症中拥有一样的控制功能。经过敲除MHC-I成员B2M,发掘无改变IGSF8 mRNA或蛋白表达,显示IGSF8对NK细胞毒性的控制可能是由于MHC-I不关联的机制介导的。在共培养过程中的观察结果显示,IGSF8经过抑制脱颗粒来控制NK细胞介导的细胞毒性。
因为IGSF8基因在人和小鼠之间的序列同源性,科研人员运用两种不同的CRISPR gRNAs敲除小鼠模型(B16-F10)中的IGSF8,一样观察到NK细胞杀伤明显增多。另外,IGSF8敲除在体外对B16-F10细胞生长影响不大,但在身体可明显降低C57BL/6同基因小鼠的肿瘤生长。流式细胞术检测肿瘤浸润的CD45+细胞表示,敲除B16-F10中的IGSF8引起NK和CD8 T细胞明显增多,对巨噬细胞的影响很小。RNA-seq图谱表示,IGSF8敲除引起肿瘤中NK细胞介导的细胞杀伤力明显上调,抗原加工和呈递增多,T细胞信号传导增多。以上科研结果显示,IGSF8是一个NK细胞检测点和新的免疫治疗靶点。(图3)
2、IGSF8的控制机制
科研人员重视到,IGSF8蛋白一般与PBMC中的静息NK细胞存在弱相互功效,但在科研中的CRISPR筛选中运用的扩增NK细胞中,这种相互功效显着加强。
科研人员采用了两种不同的办法,以鉴定IGSF8在人NK细胞上的结合部位。首先比较两种细胞群体之间的RNA-seq谱,发掘KIR3DL2是差异表达的高数量受体。其次进行CRISPR筛选,再次确定了KIR3DL2基因在NK细胞中的缺失会降低IGSF8与NK细胞的结合程度。(图4)
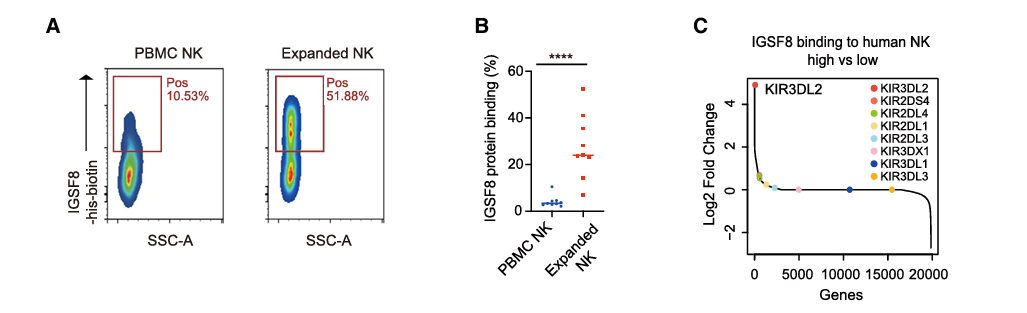
KIR3DL2是杀伤细胞免疫球蛋白样受体(KIRs)的一员,3D结构建模表示,IGSF8与人和小鼠MHC-I和B2M蛋白的alpha3结构域拥有高度的结构类似性,证实IGSF8能够代替MHC-I/B2M与KIR3DL2结合。
科研人员用几种办法验证了KIR3DL2和IGSF8之间的特异性相互功效。包含但不限于测绘亲和力、特异性抗体阻断测试以及高通量相互功效筛选等,证明了IGSF8和人类NK细胞上的KIR3DL2受体之间存在特异性相互功效。
接下来,科研人员试图评定IGSF8-KIR3DL2相互功效对NK细胞介导的细胞毒性的影响。一系列发掘供给了IGSF8经过其与KIR3DL2的特异性相互功效控制NK细胞介导的细胞杀伤力的证据。
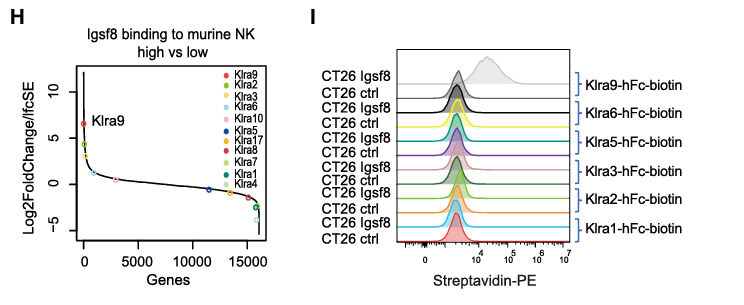
在小鼠中Ly49家族的Klra9与人KIR3DL2功能类似,其mRNA在与小鼠IGSF8蛋白结合的NK细胞中显著更丰富,其蛋白与CT26-IGSF8细胞存在特异性结合。KIR3DL2和Klra9的镜像功能和遗传特征显示,它们与IGSF8的相互功效在调节NK细胞中起一样功效。(图5)
3、IGSF8在癌症中的高表达
在癌症基因组图谱(TCGA)肿瘤谱中,IGSF8 mRNA在黑色素瘤中最为丰富,并且在许多实体肿瘤类型中明显过表达。不同细胞中的RNA 测序分析亦证实,IGSF8在恶性细胞中表达最高。IGSF8 mRNA的表达与MHC-I成员B2M呈负关联。
对公开数据的调查显示,IGSF8 较高的肿瘤拥有较差的免疫浸润、对细胞毒性的低易感性、抗原呈递缺陷以及抗PD1治疗的抗性。与其他实体肿瘤相比,肾癌拥有不同的肿瘤免疫微环境和ICB反应特征,和IGSF8在肾癌中亦与其他实体肿瘤不同,支持其做为免疫检测点的潜在功效。(图6)
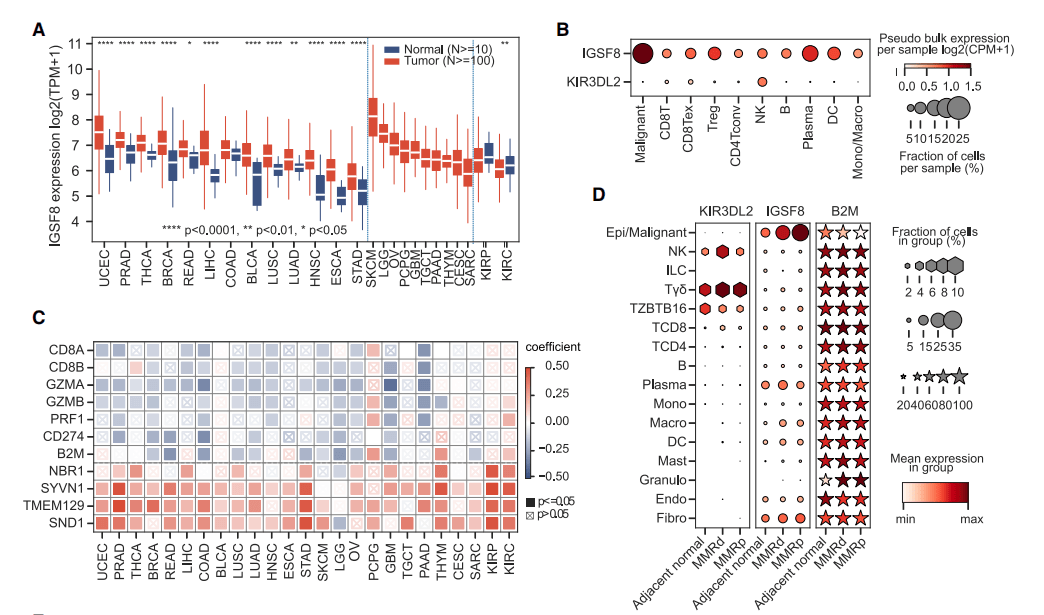
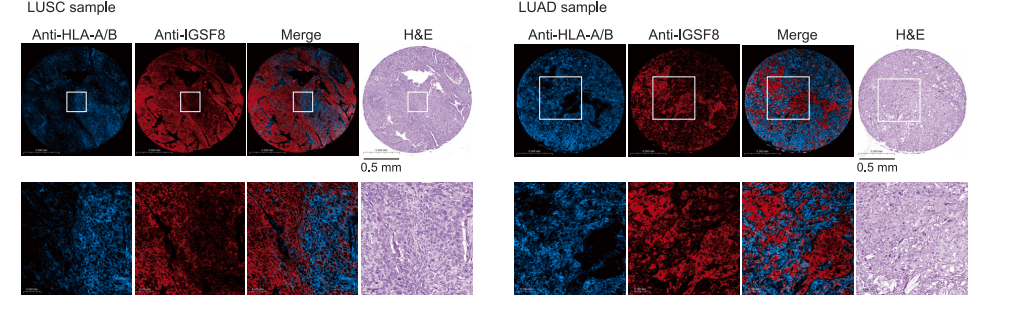
科研人员进一步在蛋白质水平上进行验证,经过在多种肿瘤组织上进行免疫组化染色,观察到MHC-I和IGSF8蛋白在相同肿瘤样本中不同恶性细胞之间的异质性和反向表达。这一结果提示IGSF8在MHC-I缺乏的肿瘤中逃避NK细胞攻击的潜在功效。(图7)
科研人员结合IGSF8 mRNA表达与临床结果之间的关系,发掘良好的抗原呈递和低IGSF8表达可能是抗PD1反应的信息预测或指标。
4、阻断IGSF8与其NK受体相互功效
经过小鼠模型,科研人员推断经过抗体系统阻断IGSF8可能拥有良好的耐受性。随之研发了一种针对IGSF8的高亲和力高特异性抗体(IGSF8.06),以阻断IGSF8与其结合受体之间的相互功效。
在体外评定中,发掘它能够明显加强扩增NK细胞对AGS和COLO205细胞的细胞毒性。该抗体还增多了PBMC源自的NK细胞对过表达IGSF8或HLA-C的K562细胞的杀伤力。
在组织模型中,再次观察到PBMC源自的NK细胞在IGSF8.06治疗后对这些恶性细胞的杀伤功效上升。
在小鼠模型中,IGSF8.06抗体明显加强表达Klra9的扩增小鼠脾源性NK细胞对小鼠黑色素瘤B16-F10细胞的细胞毒性。总之,这些结果显示,IGSF8.06抗体经过阻断IGSF8与其NK受体的相互功效来加强NK细胞对恶性细胞的杀伤力。
5、IGSF8.06抗体在身体的抗肿瘤功效
科研人员在B16-F10同基因肿瘤模型中检测了IGSF8.06抗体的身体疗效。在肿瘤生长控制和小鼠存活率方面,能够观察到明显的身体疗效。科研结果显示,抗IGSF8的抗体阻断IGSF8与其NK受体之间的相互功效,激活先天免疫,促进抗原呈递,以NK细胞依赖的方式控制肿瘤生长,并与抗PD1治疗拥有叠加效应。
这项科研发掘了IGSF8,这是一个以前未被发掘的NK细胞检测点,在恶性细胞上高度表达以控制NK细胞介导的细胞杀伤。
IGSF8是一个NK细胞检测点,IGSF8可能拥有额外的癌细胞内在和外在功能。科研人员针对此发掘研发了IGSF8.06抗体,专门针对在恶性细胞上表达的IGSF8,阻断IGSF8与NK细胞的相互功效。该抗体的独特之处在于,它刺激NK细胞杀死拥有抗原呈递缺陷和应激信号的恶性细胞,而保存表示正常MHC - 1且无应激信号的正常细胞。这种抗体亦可能有助于防止最初对抗PD-1或抗PD-L1抗体有反应的肿瘤经过抗原呈递丢失而产生的耐药性。经过PD1/PD-L1双重靶向T细胞和经过IGSF8/KIR3DL2双重靶向NK细胞可能达到最佳疗效,并减少免疫治疗耐药的显现。
科研人员在文末说到:日前正在癌症病人的I期临床科研中科研抗IGSF8做为癌症免疫疗法的安全性和临床活性。
DOI:https://doi.org/10.1016/j.cell.2024.03.039返回首页,查看更加多
外链论坛:http://www.fok120.com/
|